
| 序号 | 反应物 | 产物 |
| ① | KMnO4、H2O2、H2SO4 | K2SO4、MnSO4… |
| ② | Cl2、FeBr2 | FeCl3、FeBr3 |
| ③ | KClO3、浓盐酸 | Cl2、… |
| A. | 第①组反应的其余产物为H2O和O2 | |
| B. | 第②组反应中Cl2与FeBr2的物质的量之比为1:2 | |
| C. | 第③组反应中还原产物是KCl,生成3 mol Cl2转移电子6mol | |
| D. | 氧化性由强到弱顺序为ClO3->Cl2>Br2>Fe3+ |
分析 A.反应中KMnO4→MnSO4,Mn元素化合价由+7价降低为+2价,根据电子转移守恒,H2O2中氧元素化合价升高,应生成氧气,根据元素守恒还生成水;
B.由元素化合价可知,反应中只有亚铁离子被氧化,结合电子转移守恒计算;
C.由信息可知,Cl元素化合价由-1价升高为0价,计算转移电子;
D.氧化剂氧化性强于氧化产物氧化性,由②可知Fe3+不能氧化Br-,氧化性Br2>Fe3+.
解答 解:A.反应中KMnO4→MnSO4,Mn元素化合价由+7价降低为+2价,根据电子转移守恒,H2O2中氧元素化合价升高,生成氧气,根据H元素守恒可知还生成水,故A正确;
B.由元素化合价可知,反应中只有亚铁离子被氧化,根据电子转移守恒2n(C12)=n(FeBr2),即n(C12):n(FeBr2)=1:2,故B正确;
C.由信息可知,Cl元素化合价由-1价升高为0价,生成3mo1C12,只有5molCl得到电子,转移电子为5mo1,故C错误;
D.氧化剂氧化性强于氧化产物氧化性,由③可知氧化性ClO3->Cl2,由②可知氧化性Cl2>Br2,由②可知Fe3+不能氧化Br-,氧化性Br2>Fe3+,故D正确;
故选C.
点评 本题考查氧化还原反应,为高频考点,把握元素的化合价变化、基本概念为解答的关键,侧重分析与应用能力的考查,注意氧化的先后及电子守恒应用,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 在氧化还原反应中,还原剂一定是失去电子的反应物 | |
| B. | 在氧化还原反应中,非金属单质一定是氧化剂 | |
| C. | 某元素从化合态转变为游离态时,该元素一定被还原 | |
| D. | 金属阳离子被还原不一定得到金属单质 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 弱酸 | 电离平衡常数(25℃) |
| HClO | K=2.98×10-8 |
| H2CO3 | K1=4.3×10-7 K2=5.6×10-11 |
| H2SO3 | K1=1.54×10-2 K2=1.02×10-7 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
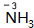 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com