
| A、Ca2+、K+、CO32-、Cl- |
| B、K+、NH4+、HCO3-、OH- |
| C、H+、Fe2+、ClO-、SO42- |
| D、Na+、Ba2+、OH-、NO3- |


 英才点津系列答案
英才点津系列答案 红果子三级测试卷系列答案
红果子三级测试卷系列答案科目:高中化学 来源: 题型:
| A、明矾用于净水:Al3++3H2O═Al(OH)3↓+3H+ |
| B、钢铁吸氧腐蚀的负极反应:Fe-3e-═Fe3+ |
| C、向明矾溶液中加入少量氢氧化钡溶液:Al3++SO42-+Ba2++3OH-═BaSO4↓+Al(OH)3↓ |
D、苯酚钠饱和溶液中通入少CO2: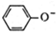 +CO2+H2O→ +CO2+H2O→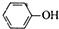 +HCO3- +HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:
 如图是甲醇/过氧化氢燃料电池内部结构示意图.工作时,甲醇和过氧化氢分别进入燃料电池的燃料腔和氧化剂腔,在各自催化剂的作用下发生反应,并向外界输出电能.下列说法不正确的是( )
如图是甲醇/过氧化氢燃料电池内部结构示意图.工作时,甲醇和过氧化氢分别进入燃料电池的燃料腔和氧化剂腔,在各自催化剂的作用下发生反应,并向外界输出电能.下列说法不正确的是( )| A、该电池的正极反应式:H2O2+2H++2e-═2H2O |
| B、燃料腔中的多孔石墨电极为该燃料电池的负极,负极产生的H+通过质子交换膜流向正极 |
| C、电池工作时,1mol甲醇被氧化有6 mol电子转移 |
| D、电路中的电子经正极、负极、质子交换膜后再回到正极,形成闭合回路 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、4种 | B、6种 |
| C、10种 | D、12种 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、8种 | B、16种 |
| C、24种 | D、28种 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 在化学反应中断键位置说法错误的是( )
在化学反应中断键位置说法错误的是( )| A、乙醇在铜催化下与氧气反应,在②④位置断裂,所以只有与羟基直接相连的碳原子上有氢原子才能发生催化氧化 |
| B、乙醇与钠反应,在④位置断裂 |
| C、乙醇与浓硫酸在140℃时,在③或④位置断裂,该反应属于取代反应 |
| D、乙醇与浓硫酸在170℃时,在②③位置断裂,以水分子的形式消去,属于消去反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、常温下,pH=7的任何溶液中含有OH-数目均为10-7NA |
| B、23g乙醇中含有C-H键的数目为3NA |
| C、4.8g O2和O3以任何比例组成的混合气体中含有的氧原子数目均为0.3NA |
| D、常温常压下,2.24L Cl2与足量铁粉充分反应,转移的电子数目为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| T/K | T1 | T2 | T3 |
| K | 1.00×107 | 2.45×105 | 1.88×103 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com