
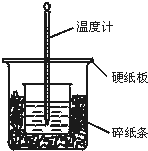
 50mL 0.50mol/L盐酸与50mL 0.55mol/L NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
50mL 0.50mol/L盐酸与50mL 0.55mol/L NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:分析 (1)根据量热计的构造来判断该装置缺少的仪器;
(2)中和热测定实验成败的关键是保温工作;
(3)大烧杯上如不盖硬纸板,会使一部分热量散失;
(4)反应放出的热量和所用酸以及碱的量的多少有关,并根据中和热的概念和实质来回答;
(5)根据弱电解质电离吸热分析;氢氧化钠不过量,反应不完全,放出的热量偏小;
(6)根据中和热的概念:稀的强酸和强碱反应生成1mol水所放出的热量求出中和热以及中和热的热化学方程式.
解答 解:(1)由量热计的构造可知该装置的缺少仪器是环形玻璃搅拌棒;
故答案为:环形玻璃搅拌棒;
(2)中和热测定实验成败的关键是保温工作,大小烧杯之间填满碎泡沫塑料的作用是减少实验过程中的热量损失,
故答案为:减少实验过程中的热量损失;
(3)大烧杯上如不盖硬纸板,会使一部分热量散失,求得的中和热数值将会减小,
故答案为:偏小;
(4)反应放出的热量和所用酸以及碱的量的多少有关,改用60ml0.50mol/L盐酸进行反应,与上述实验相比,生成水的量增多,所放出的热量偏高,但是中和热是指稀强酸与稀强碱发生中和反应生成1molH2O放出的热量,与酸碱的用量无关;
故答案为:不相等;相等;因中和热是指稀强酸与稀强碱发生中和反应生成1molH2O放出的热量,与酸碱的用量无关;
(5)氨水为弱碱,电离过程为吸热过程,所以用氨水代替稀氢氧化钠溶液反应,反应放出热量偏小,中和热的数值会偏小;氢氧化钠不过量,反应不完全,放出的热量偏小,中和热的数值会偏小;
故答案为:偏小;偏小;
(6)1.00L 1.00mol•L-1 H2SO4溶液与2.00L 1.00mol•L-1 NaOH溶液完全反应,放出114.6kJ的热量,即生成2mol水放出114.6kJ的热量,反应的反应热为-11.46kJ/mol,中和热为-57.3kJ/mol,则中和热的热化学方程式:$\frac{1}{2}$H2SO4(aq)+NaOH(aq)═$\frac{1}{2}$Na2SO4(aq)+H2O(l)△H=-57.3 kJ/mol;
故答案为:-57.3 kJ/mol;$\frac{1}{2}$H2SO4(aq)+NaOH(aq)═$\frac{1}{2}$Na2SO4(aq)+H2O(l)△H=-57.3 kJ/mol.
点评 本题考查了中和热的测定方法,题目难度中等,明确中和热的测定步骤为解答关键,注意掌握中和热计算方法,试题培养了学生的分析能力及化学实验能力.


 智慧小复习系列答案
智慧小复习系列答案科目:高中化学 来源: 题型:选择题
| A. | ③⑤ | B. | 只有③ | C. | ③④⑤ | D. | ①③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaHSO4溶液中c(Na+)=c(OH-)+c(HSO${\;}_{4}^{-}$)+2c(SO${\;}_{4}^{2-}$) | |
| B. | 混合后溶液pH值为13 | |
| C. | 混合溶液中c(Ba2+)+c(Na+)+c(H+)=c(SO${\;}_{4}^{2-}$)+c(OH-) | |
| D. | 加入Ba(OH)2溶液后混合溶液水电离程度比纯水的小 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 4:11 | B. | 16:9 | C. | 8:11 | D. | 32:9 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 粒子种类不相同 | B. | c(OH-)前者大于后者 | ||
| C. | 均存在电离平衡和水解平衡 | D. | 分别加入NaOH固体,c(CO32-)均增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com