
| 测定次数 | 第一次 | 第二次 | 第三次 |
| 初始读数(mL) | 0.40 | 0.90 | 0.00 |
| 终点读数(mL) | 25.05 | 21.00 | 19.90 |
分析 (1)测定氢气反应速率需要测定氢气体积、测定反应时间;
(2)甲.在醋酸钠溶液中滴入2滴酚酞,加热后红色加深,说明加热促进醋酸钠水解;
乙.用等浓度纯碱溶液去油污,热溶液比冷溶液效果好,说明加热促进纯碱水解;
丙.硝酸铵溶解时吸热;
丁.在氨水中加入氯化铵固体,溶液的pH变小,说明铵根离子抑制一水合氨电离;
(3)A.酸式滴定管用蒸馏水洗净后,未用待测盐酸润洗,会导致盐酸浓度降低;
B.滴定前,碱式滴定管尖嘴有气泡,滴定后气泡消失,导致碱溶液体积偏大;
C.滴定终点读数时,仰视定管刻度,其他操作正确,导致碱溶液体积偏大;
(4)①酸式滴定管只能盛放酸性溶液;
②滴定终点的现象是:当滴下最后一滴标准溶液,溶液由无色变为浅紫色,且在30秒内不褪去;
③第一次和第二次、第三次的量相差较大,舍去,所以使用的高锰酸钾平均体积=$\frac{(21.00-0.90)+(19.90-0.00)}{2}$mL=20.00mL,
根据高锰酸钾和草酸的关系式计算.
解答 解:(1)测定氢气反应速率需要测定氢气体积、测定反应时间,所以用分液漏斗、锥形瓶、导管、注射器、双孔胶塞、秒表和铁架台可以测定锌和稀硫酸反应生成氢气的反应速率,故答案为:可以;
(2)甲.在醋酸钠溶液中滴入2滴酚酞,加热后红色加深,说明加热促进醋酸钠水解,则证明醋酸钠水解是吸热反应,故正确;
乙.用等浓度纯碱溶液去油污,热溶液比冷溶液效果好,说明加热促进纯碱水解,则说明纯碱水解是吸热反应,故正确;
丙.硝酸铵溶解时吸热,不能据此判断盐类水解是吸热反应,故错误;
丁.在氨水中加入氯化铵固体,溶液的pH变小,说明铵根离子抑制一水合氨电离,与盐类水解的反应热无关,故错误;
故选甲乙;
(3)A.酸式滴定管用蒸馏水洗净后,未用待测盐酸润洗,会导致盐酸浓度降低,所以测定结果偏低,故错误;
B.滴定前,碱式滴定管尖嘴有气泡,滴定后气泡消失,导致碱溶液体积偏大,导致测定结果偏高,故正确;
C.滴定终点读数时,仰视定管刻度,其他操作正确,导致碱溶液体积偏大,导致测定结果偏高,故正确;
故选BC;
(4)①酸式滴定管只能盛放酸性溶液,高锰酸钾溶液呈酸性,所以只能用酸式滴定管,故答案为:酸式;
②滴定终点的现象是:当滴下最后一滴标准溶液,溶液由无色变为浅紫色,且在30秒内不褪去,故答案为:当滴下最后一滴标准溶液,溶液由无色变为浅紫色,且在30秒内不褪去;
③第一次和第二次、第三次的量相差较大,舍去,所以使用的高锰酸钾平均体积=$\frac{(21.00-0.90)+(19.90-0.00)}{2}$mL=20.00mL,
根据高锰酸钾和草酸的关系式得c(H2C2O4)=$\frac{0.1000mol/L×20mL}{20mL}×\frac{5}{2}$=0.2500mol/L,
故答案为:0.2500.
点评 本题考查较综合,涉及化学实验方案评价、中和滴定等知识点,侧重考查分析判断及计算、实验操作能力,明确实验原理是解本题关键,注意(4)题第一次高锰酸钾溶液体积要舍去,为易错点.


科目:高中化学 来源: 题型:解答题
 三氯氧磷(POCl3)常温下为无色液体,有广泛应用.近年来三氯氧磷的工业生产由三氯化磷的“氧气直接氧化法”代替传统的三氯化磷“氯化水解法”(由氯气、三氯化磷和水为原料反应得到).
三氯氧磷(POCl3)常温下为无色液体,有广泛应用.近年来三氯氧磷的工业生产由三氯化磷的“氧气直接氧化法”代替传统的三氯化磷“氯化水解法”(由氯气、三氯化磷和水为原料反应得到).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | D、E以原子个数比2:1形成的化合物,只含离子键 | |
| B. | 元素A、B、C的单质晶体可能属于同种类型的晶体,也可能是不同类型的晶体.如果B在A2B7CD分子中有四种不同的环境,则该分子不能与硫酸反应 | |
| C. | 含E的某种离子的水溶液,滴加某种含A、C或A、C、D元素组成的离子的溶液,均可生成配合物 | |
| D. | B与C形成的化合物其沸点一定高于A与B形成的化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
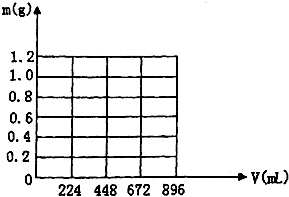 将KOH和Ca(OH)2混合物1.86g全部溶于一定量水中形成稀溶液,再缓缓通入足量的CO2气体.当生成沉淀的质量刚好最大时,消耗CO2的体积为224mL(标准状况,忽略CO2溶于水情况,以下情况相同.)
将KOH和Ca(OH)2混合物1.86g全部溶于一定量水中形成稀溶液,再缓缓通入足量的CO2气体.当生成沉淀的质量刚好最大时,消耗CO2的体积为224mL(标准状况,忽略CO2溶于水情况,以下情况相同.)查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲型H1N1流感病毒是一种油脂 | |
| B. | 我们所吃的豆腐中主要含有蛋白质 | |
| C. | 棉花和蚕丝的主要成分都是纤维素 | |
| D. | 糯米中的淀粉一经发生水解反应就酿造成酒 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
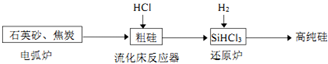
| 物质 | Si | SiCl4 | SiHCl3 | SiH2Cl2 | SiH3Cl | HCl | SiH4 |
| 沸点/℃ | 2355 | 57.6 | 31.8 | 8.2 | -30.4 | -84.9 | -111.9 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙二酸二乙酯、乙二酸乙二酯、二乙酸乙二酯它们互为同分异构体 | |
| B. | 用氢氧化铁胶体进行电泳实验时,阴极区域颜色加深,说明氢氧化铁胶体带正电荷 | |
| C. | 含Fe元素的质量分数为70%的铁红一定是纯净物 | |
| D. | 在干冰晶体中,每个CO2分子周围与之最接近而且距离相等的CO2分子有6个 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 可燃冰是可以燃烧的冰 | |
| B. | 明矾的化学式:KAl(SO4)2 | |
| C. | 酒精、水玻璃、福尔马林都是非电解质 | |
| D. | 肽键是蛋白质一级结构中的主键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2H2(g)+O2(g)═2H2O(g);△H1 2H2(g)+O2(g)═2H2O(l);△H2 | |
| B. | S(s)+O2═SO2(g);△H1 S(g)+O2═SO2(g);△H2 | |
| C. | C(s)+$\frac{1}{2}$O2(g)═CO(g);△H1 C(s)+O2(g)═CO2(g);△H2 | |
| D. | H2(g)+Cl2(g)═2HCl(g);△H1$\frac{1}{2}$H2(g)+$\frac{1}{2}$Cl2(g)═HCl(g);△H2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com