
常温下,pH=11的氨水和pH=1的盐酸等体积混合(混合溶液体积为两溶液体积之和),恰好完全反应,则下列说法错误的是
A.氨水的浓度大于盐酸的浓度
B.原氨水中有1%的含氮微粒为NH4+
C.氨水中水电离出的c(H+)是盐酸中水电离出的c(H+)的100倍
D.混合溶液中c(NH4+)+c(NH3·H2O)+c(NH3)=5×10-4mol/L
AD
【解析】
试题分析:pH=11的氨水(OH-
0.001mol/L)和pH=1的盐酸(H+0.1mol/L)中前都的氢氧根和后都的氢离子浓度相比是1:100,由于一水合氨是弱电解质,等体积混合,恰好完全反应说明氨气物质的量和氯化氢物质的量相等,故氨水的浓度大于盐酸的浓度,故A正确;pH=11的氨水溶液,c(碱)=0.1mol/L,c(OH﹣)=c(NH4+)=10﹣3mol/L,则原氨水中有1%的含氮微粒为NH4+,故B正确;氨水中水电离出的c(H+)是10﹣11mol/L,盐酸中水电离出的c(H+)是10﹣13mol/L,前者是后者的100倍,C正确;由于氯化氢和氨气恰好完全反应,说明两者物质的量相同,再根据氮元素守恒:反应后的溶液中NH4+、NH3•H2O与NH3三种微粒的平衡浓度之和为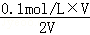 =0.05mol•L﹣1,故D错误;
=0.05mol•L﹣1,故D错误;
考点:本题考查酸碱混合溶液中离子浓度的关系,注意恰好完全反应为解答的关键,明确反应后生成氯化铵即可解答,结合物料守恒及电离即可解答,题目难度中等。


科目:高中化学 来源:2013届辽宁省沈阳二中高三第四次阶段测试化学试卷(带解析) 题型:单选题
常温下,pH=11的氨水和pH=1的盐酸等体积混合后(不考虑混合后溶液体积的变化),恰好完全反应,则下列说法不正确的是( )
| A.弱碱的浓度大于强酸的浓度 |
| B.反应后的溶液呈酸性 |
| C.原氨水中有1%的含氮粒子为NH |
| D.反应后的溶液中NH、NH3·H2O与NH3三种粒子的平衡浓度之和为0.05 mol/L |
查看答案和解析>>
科目:高中化学 来源:2013-2014学年河北省邯郸市高三第一次模拟考试理综化学试卷(解析版) 题型:选择题
常温下,pH=11的氨水和pH=1的盐酸等体积混合(混合溶液体积为两溶液体积之和),恰好完全中和,则下列说法错误的是
A.氨水的浓度等于盐酸的浓度
B.原氨水中有1%的含氮微粒为NH4+
C.氨水中水电离出的c(H+)是盐酸中水电离出的c(H+)的100倍
D.混合溶液中c(NH4+)+c(NH3·H2O)+c(NH3)=5×10-4mol·L-1
查看答案和解析>>
科目:高中化学 来源:2012-2013学年辽宁省高三第四次阶段测试化学试卷(解析版) 题型:选择题
常温下,pH=11的氨水和pH=1的盐酸等体积混合后(不考虑混合后溶液体积的变化),恰好完全反应,则下列说法不正确的是( )
A.弱碱的浓度大于强酸的浓度
B.反应后的溶液呈酸性
C.原氨水中有1%的含氮粒子为NH
D.反应后的溶液中NH、NH3·H2O与NH3三种粒子的平衡浓度之和为0.05 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
根据下列化合物:①NaCl、②NaOH、③HCl、④NH4Cl、⑤CH3COONa、⑥CH3COOH、⑦NH3·H2O、⑧H2O,回答下列问题。
(1)NH4Cl溶液显________性,用离子方程式表示原因________,其溶液中离子浓度大小顺序为___________________。
(2)常温下,pH=11的CH3COONa溶液中,水电离出来的c(OH-)=________,在pH=3的CH3COOH溶液中,水电离出来的c(H+)=________。
(3)已知纯水中存在如下平衡:H2O+H2O ![]() H3O++OH- ΔH>0,现欲使平衡向右移动,且所得溶液显酸性,可选择的方法是________(填字母序号)。
H3O++OH- ΔH>0,现欲使平衡向右移动,且所得溶液显酸性,可选择的方法是________(填字母序号)。
A.向水中加入NaHSO4固体 B.向水中加Na2CO3固体
C.加热至100℃[其中c(H+)=1×10-6mol·L-1] D.向水中加入(NH4)2SO4固体
(4)若将等pH、等体积的②NaOH和⑦NH3·H2O分别加水稀释m倍、n倍,稀释后两种溶液的pH仍相等,则m________(填“<”、“>”或“=”)n。
(5)除⑧H2O外,若其余7种溶液的物质的量浓度相同,则这7种溶液按pH由大到小的顺序为:____________________(填序号)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com