
| A. | 一定温度、压强下,气体体积由其物质的量的多少决定 | |
| B. | 两种物质的物质的量相同,则它们在标准状况下的体积相同 | |
| C. | 同温同压下,气体的密度与气体的相对分子质量成正比 | |
| D. | 同温同体积时,气体物质的物质的量越大,则压强越大 |
分析 A.一定温度、压强下,气体体积由分子数决定;
B.两种物质不一定都是气体;
C.同温同压下,气体的密度之比等于摩尔质量之比,也等于相对分子质量之比;
D.在同温同体积时,气体压强与物质的量成正比.
解答 解:A.一定温度、压强下,气体摩尔体积相等,根据V=nVm知,气体体积由其物质的量的多少决定,故A正确;
B.标况下,两种物质不一定都是气体,它们物质的量相等,占有的体积不一定相等,故B错误;
C.同温同压下,气体的密度之比等于摩尔质量之比,也等于相对分子质量之比,即气体的密度与气体的相对分子质量成正比,故C正确;
D.在同温同体积时,气体压强与物质的量成正比,所以在同温同体积时,气体物质的物质的量越大,则压强越大,故D正确;
故选B.
点评 本题考查阿伏伽德罗定律及其推论,注意根据PV=nRT理解阿伏加德罗定律及其推论、温度及压强对气体摩尔体积的影响,难度中等.


科目:高中化学 来源: 题型:选择题
| A. | ①②④ | B. | ①③④ | C. | ③④ | D. | ②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
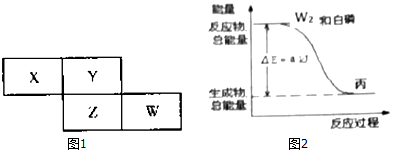
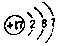 .
. .白磷固体和W2气体反应,生成1mol液态丙时,能量变化如图2所示,写出该反应的热化学方程式$\frac{1}{4}$P4(s)+$\frac{3}{2}$Cl2(g)=PCl3(l)△H=-akJ/mol.已知1mol白磷固体和W2气体反应,生成固态丁时,放热bkJ,则1mol固态丁转化为液态丙时的△H=($\frac{1}{4}$b-a)KJ/mol.
.白磷固体和W2气体反应,生成1mol液态丙时,能量变化如图2所示,写出该反应的热化学方程式$\frac{1}{4}$P4(s)+$\frac{3}{2}$Cl2(g)=PCl3(l)△H=-akJ/mol.已知1mol白磷固体和W2气体反应,生成固态丁时,放热bkJ,则1mol固态丁转化为液态丙时的△H=($\frac{1}{4}$b-a)KJ/mol. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用酒精萃取溴水中溴单质的操作可选用分液漏斗,而后静置分液 | |
| B. | 溶解固体时烧杯在使用前必须干燥 | |
| C. | 萃取、分液前需对分液漏斗检漏,分液操作时,分液漏斗中下层液体及上层液体均从下口放出 | |
| D. | 蒸馏操作时,不可以用温度计搅拌,温度计水银球靠近蒸馏烧瓶的支管口处 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ① | C. | ③④ | D. | ①④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
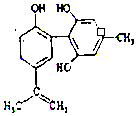
| A. | 标准状况下,22.4L HF中含有氟原子数目为NA | |
| B. | 0.1mol/L的NH4HSO4溶液中滴加0.1mol/L的Ba(OH)2溶液至沉淀刚好完全:c(NH4+)>c(OH-)>c(SO42-)>c(H+) | |
| C. | 1mol 如图物质与浓溴水反应时通常最多消耗Br2为6mol | |
| D. | 12g石墨烯(单层石墨)中含有六元环的个数为0.5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2.3 g钠与足量丙三醇反应,转移电子数为0.3×6.02×1023 | |
| B. | 标准状况下,22.4 L乙醇的共价键数为8×6.02×1023 | |
| C. | 标准状况下,5.6 L甲醛所含的电子数为4×6.02×1023 | |
| D. | 100 mL 1 mol•L-1醋酸溶液中,H+的个数为0.1×6.02×1023 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com