
| A. | 证明一瓶红棕色气体是溴蒸气还是二氧化氮,可用湿润的碘化钾一淀粉试纸检验,观察试纸颜色的变化 | |
| B. | 铝热剂溶于足量稀盐酸再滴加KSCN溶液,未出现血红色,该铝热剂不含氧化铁 | |
| C. | 测氯水的pH可用玻璃棒蘸取氯水点在pH试纸上,待其变色后和标准比色卡比较 | |
| D. | 向硅酸钠溶液中,滴入硫酸,可以验证S的非金属性强于Si |
分析 A.溴蒸气、二氧化氮均可氧化KI;
B.Al与氯化铁反应生成亚铁离子,遇KSCN溶液不变色;
C.氯水中含HClO,具有漂白性,不能利用试纸测到其pH;
D.发生强酸制取弱酸的反应,可知硫酸的酸性大于硅酸的酸性.
解答 解:A.因溴能氧化KI,二氧化氮与水反应生成的硝酸也能氧化KI,则证明一瓶红棕色气体是溴蒸气还是二氧化氮,不能用湿润的碘化钾一淀粉试纸检验,可选用水,故A错误;
B.若铝热剂含Al与氧化铁,溶于盐酸时,可发生Al与氯化铁反应生成亚铁离子,遇KSCN溶液不变色,则铝热剂溶于足量稀盐酸再滴加KSCN溶液,未出现血红色,铝热剂中可含铁的氧化物,故B错误;
C.氯水中含HClO,具有漂白性,不能利用试纸测其pH,可选用pH计测其pH,故错误;
D.向硅酸钠溶液中,滴入硫酸,发生强酸制取弱酸的反应,可知硫酸的酸性大于硅酸的酸性,则可以验证S的非金属性强于Si,故D正确;
故选D.
点评 本题考查化学实验方案的评价,为高频考点,把握物质的性质、发生的反应、非金属性比较、pH测定等为解答的关键,侧重分析与实验能力的考查,注意实验的评价性分析,题目难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 将铁粉加到稀硝酸中 | |
| B. | 向稀盐酸中滴入Na2CO3溶液 | |
| C. | 向MgSO4、H2SO4的混合溶液中加入过量的Ba(OH)2溶液 | |
| D. | 将CO2通入一定量的NaOH溶液中 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 容器内压强不再随时间变化 | |
| B. | 单位时间内消耗0.1 mol X 的同时生成0.3 molZ | |
| C. | 容器内XYZ的浓度比为1:2:3 | |
| D. | 容器内各物质浓度不再随时间变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 实验用剩的药品应放回原试剂瓶中 | |
| B. | 切割白磷时应该在水下进行 | |
| C. | 测某酸性溶液的pH时,先用水将pH试纸湿润 | |
| D. | 在“粗盐中难溶性杂质的去除”实验中,将蒸发皿中的溶液直接蒸干 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
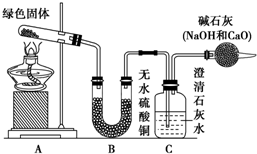 铜器久置,表面会生成一层绿色固体,为了解铜在空气中的腐蚀情况,某化学兴趣小组收集家中铜器表面的绿色固体进行探究.查阅相关资料后,猜想该绿色物质可能是铜的碳酸盐.
铜器久置,表面会生成一层绿色固体,为了解铜在空气中的腐蚀情况,某化学兴趣小组收集家中铜器表面的绿色固体进行探究.查阅相关资料后,猜想该绿色物质可能是铜的碳酸盐.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只含共价键的物质一定是共价化合物 | |
| B. | HF、HCl、HBr、HI沸点逐渐增加是因为分子量逐渐增加 | |
| C. | 含有离子键的化合物一定是离子化合物 | |
| D. | 金属与非金属之间形成的是离子键,非金属之间则形成的是共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | N2H4(g)+2H2O2(l)═N2(g)+4H2O(l)△H=+817.63 kJ•mol-1 | |
| B. | N2H4(g)+2H2O2(l)═N2(g)+4H2O(g)△H=-641.63 kJ•mol-1 | |
| C. | N2H4(g)+2H2O2(l)═N2(g)+4H2O(l)△H=-641.63 kJ•mol-1 | |
| D. | N2H4(g)+2H2O2(l)═N2(g)+4H2O(g)△H=-817.63 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 该混盐具有和漂白粉相似的化学性质 | |
| B. | 该混盐的水溶液呈中性 | |
| C. | 该混盐与硫酸反应生成1摩尔氯气时,转移了1摩尔电子 | |
| D. | 该混盐中氯元素的化合价为零 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com