
雾霾已经严重影响我们的生存环境。火力发电厂释放出大量的氮氧化物(NOx)、二氧化硫和二氧化碳等气体会造成环境污染。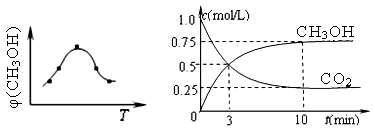
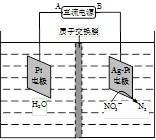
图22-1 图22-2 图22-3
(1)利用甲烷催化还原NOx:
①CH4(g) + 4NO2(g) =" 4NO(g)" + CO2(g) + 2H2O(g) △H1=-574kJ?mol-1
②CH4(g) + 4NO(g) = 2N2(g) + CO2(g) + 2H2O(g) △H2=-1160kJ?mol-1
甲烷直接将NO2还原为N2的热化学方程式为 。
(2)将CO2转化为甲醇的热化学方程式为:
CO2(g) + 3H2(g) = CH3OH(g) + H2O(g) △H3
①取五份等体积CO2和H2的混合气体(物质的量之比均为1∶3),分别加入温度不同、容积相同的恒容密闭容器中,发生上述反应,反应相同时间后,测得甲醇的体积分数φ(CH3OH) 与反应温度T的关系曲线(见图22-1),则上述CO2转化为甲醇反应的△H3 0(填“>”、“<”或“=”)。
②在一恒温恒容密闭容器中充入1mol CO2和3mol H2,进行上述反应。测得CO2和CH3OH(g)的浓度随时间变化如图22-2所示。
下列说法正确的是 (填字母代号)。
| A.第10min后,向该容器中再充入1molCO2和3molH2,则再次达到平衡时c(CH3OH) ="1.5" mol/L |
| B.达到平衡时,氢气的转化率为0.75 |
| C.0~10分钟内,氢气的平均反应速率为0.075mol/(L?min) |
| D.该温度下,反应的平衡常数的值为3/16 |
(1)CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g) △H=-867kJ?mol-1 (2)①< ②B
(3)12NH3+3O2+4SO2+4NO2+6H2O=4(NH4)2SO4+4NH4NO3
(4)①A, 2NO3-+6H2O+10e-=N2↑+12OH- ②7.2
解析试题分析:(1)(①+②)÷2可得:CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g) △H=-867kJ?mol-1
(2)① 由甲醇的体积分数φ(CH3OH) 与反应温度T的关系曲线可以看出:当升高温度时甲醇的体积分数减小,说明升高温度化学平衡向逆反应方向移动。根据平衡移动原理:升高温度,化学平衡向吸热反应反应移动,逆反应方向是吸热反应,所以正反应为放热反应,所以△H<0.② CO2(g) + 3H2(g) = CH3OH(g) + H2O(g)由图可知:反应的容器容积为1L,当反应进行到10分钟时达到平衡,此时CO2的转化率为0.75. CH3OH的平衡浓度为0.75mol/L.A. 此时若向该容器中再充入1mol CO2和3mol H2,假如平衡不发生移动,由于C(CO2)C(H2)都是原来的2倍,则再次达到平衡时c(CH3OH) ="1.5" mol/L。而实质上这是一个反应前后气体体积不等的可逆反应,增大反应物的浓度,也就增大了压强。增大压强化学平衡向气体体积减小的方向即正反应方向移动。所以当达到新的平衡时c(CH3OH)大于1.5 mol/L。错误。B.由于在反应中CO2和H2是按照1:3关系反应的,投入量也是按照1:3加入的,所以再次达到平衡时,氢气的转化率不变,仍为0.75。正确。C.0~10分钟内,V(CO2)= ΔC/Δt="0.75mol/L÷10min=" 0.075mol/( L?min) .V(H2): V(CO2)=3:1,所以V(H2) ="3" V(CO2)= 3×0.075mol/( L?min) = 0.225mol/( L?min).错误。D.该温度下,反应的平衡常数的值K="{" c(CH3OH)·c(H2O)}÷{ c(CO2)·c3(H2)}=" (0.75×0.75)" ÷{0.25×(3-0.75)3}=0.1975.错误.E.由于该反应的正反应是放热反应,所以升高温度将使平衡逆向移动,n(CH3OH)/n(CO2)减小。错误。正确选项为B。(3)该反应的化学方程为12NH3+3O2+4SO2+ 4NO2+6H2O= 4(NH4)2SO4+4NH4NO3(4)① 由于NO3- →N2 ,得到电子,所以应该接电源的负极,作阴极。即A为电源的正极,B为电源的负极。阴极反应式为2NO3-+10e-+6H2O=N2↑+12OH-。② 电解池右侧NO3-转化成N2,发生还原反应:2 NO3-+10e-+6H2O = N2↑+ 12OH- ,其电极应为阴极,则左侧发生 氧化反应:2H2O―4 e- =O2↑+4H+,其电极作阳极,与其相连的A端为电源的正极;转移1mol电子时,左侧减少0.1molN2,2.8g,右侧生成0.25molO2,8g,1molH+,由于H+可通过质子交换膜由左侧进入右侧,则右侧电解液质量实际减少:2.8g-1g=1.8g,左侧电解液质量实际减少:8g+1g=9g,则两侧质量差为9g -1.8g=7.2g。
考点:考查盖斯定律、外界条件对化学速率、化学平衡的影响及电化学降解NO3- 的原理等的知识。


 应用题天天练四川大学出版社系列答案
应用题天天练四川大学出版社系列答案科目:高中化学 来源: 题型:填空题
资源化利用二氧化碳不仅可减少温室气体的排放,还可重新获得燃料或重要工业产品。
(1)有科学家提出可利用FeO吸收和利用CO2,相关热化学方程式如下:6FeO(s)+CO2(g)=2Fe3O4(s)+C(s) △H="-76.0" kJ·mol一1
①上述反应中每生成1 mol Fe3O4,转移电子的物质的量为_______mol。
②已知:C(s)+2H2O(g)=CO2(g)+2H2(g) △H="+113.4" kJ·mol一1,则反应:3FeO(s)+ H2O(g)= Fe3O4(s)+ H2(g)的△H=__________。
(2)在一定条件下,二氧化碳转化为甲烷的反应如下:CO2(g)+4 H2 (g)  C H4 (g)+2 H2O(g),向一容积为2 L的恒容密闭容器中充人一定量的CO2和H2,在300℃时发生上述反应,达到平衡时各物质的浓度分别为CO2 0.2 mol·L一1,H2 0.8 mol·L一1,CH40.8 mol·L一1,H2O1.6 mol·L一1。则CO2的平衡转化率为________。300 ℃时上述反应的平衡常数K=____________________。200℃时该反应的平衡常数K=64.8,则该反应的△H_____(填“>’’或“<”)O。
C H4 (g)+2 H2O(g),向一容积为2 L的恒容密闭容器中充人一定量的CO2和H2,在300℃时发生上述反应,达到平衡时各物质的浓度分别为CO2 0.2 mol·L一1,H2 0.8 mol·L一1,CH40.8 mol·L一1,H2O1.6 mol·L一1。则CO2的平衡转化率为________。300 ℃时上述反应的平衡常数K=____________________。200℃时该反应的平衡常数K=64.8,则该反应的△H_____(填“>’’或“<”)O。
(3)华盛顿大学的研究人员研究出一种方法,可实现水泥生产时CO2零排放,其基本原理如
图所示: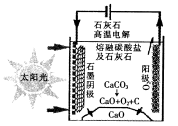
①上述生产过程的能量转化方式是____________________。
②上述电解反应在温度小于900℃时进行,碳酸钙先分解为CaO和CO2,电解质为熔融碳酸钠,则阳极的电极反应式为___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
2013年12月2日,我国在西昌卫星发射中心用“长征三号甲”运载火箭将“嫦娥三号”探月卫星成功送入太空,进一步向广寒宫探索。“长征三号甲”是三级液体助推火箭,一、二级为常规燃料,常规燃料通常指以肼(N2H4)为燃料,以二氧化氮做氧化剂。
Ⅰ.常规燃料通常指以肼(N2H4)为燃料,以二氧化氮做氧化剂。但有人认为若用氟气代替二氧化氮作氧化剂,反应释放的能量更大(两者反应生成氮气和氟化氢气体)。
已知:N2H4(g)+O2(g)=N2(g)+2H2O(g) △H = -543kJ·mol-1 H2(g)+
H2(g)+  F2(g) = HF(g) △H = -269kJ·mol-1
F2(g) = HF(g) △H = -269kJ·mol-1
H2(g)+  O2(g) = H2O(g) △H = -242kJ·mol-1
O2(g) = H2O(g) △H = -242kJ·mol-1
请写出肼和氟气反应的热化学方程式:_____________________________。
Ⅱ.氧化剂二氧化氮可由NO和 O2生成,已知在2 L密闭容器内,800 ℃时反应:
2NO(g)+O2(g) 2NO2(g) ΔH 的体系中,n(NO)随时间的变化如表:
2NO2(g) ΔH 的体系中,n(NO)随时间的变化如表:
| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)(mol) | 0.200 | 0.100 | 0.080 | 0.050 | 0.050 | 0.050 |
| n(O2)(mol) | 0.100 | 0.050 | 0.040 | 0.025 | 0.025 | 0.025 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(1)已知热化学方程式:
4Al(s) + 3O2(g) = 2Al2O3 (s) ΔH1=-3288.6 kJ·mol-1,
4Fe(s) + 3O2 (g) =2Fe2O3 (s) ΔH2=-1631.8 kJ·mol-1,
则铝粉与氧化铁发生铝热反应的热化学方程式为 。
(2)已知标准状况下44.8L氢气燃烧生成液态水时放出571.6KJ的热量,氢气的燃烧热为 ;又已知1mol液态水变成气态时需要吸收44KJ的热量,则标准状况下22.4L氢气燃烧生成气态水的热化学方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
运用化学反应原理知识研究如何利用CO、SO2等污染物有重要意义。
(1)用CO可以合成甲醇。已知:
CH3OH(g)+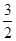 O2(g)=CO2(g)+2H2O(l) ΔH=-764.5 kJ·mol-1
O2(g)=CO2(g)+2H2O(l) ΔH=-764.5 kJ·mol-1
CO(g)+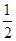 O2(g)=CO2(g) ΔH=-283.0 kJ·mol-1
O2(g)=CO2(g) ΔH=-283.0 kJ·mol-1
H2(g)+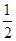 O2(g)=H2O(l) ΔH=-285.8 kJ·mol-1
O2(g)=H2O(l) ΔH=-285.8 kJ·mol-1
则CO(g)+2H2(g)  CH3OH(g) ΔH=________kJ·mol-1
CH3OH(g) ΔH=________kJ·mol-1
(2)下列措施中能够增大上述合成甲醇反应的反应速率的是________(填写序号).
a.使用高效催化剂 b.降低反应温度
c.增大体系压强 d.不断将CH3OH从反应混合物中分离出来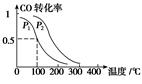
(3)在一定压强下,容积为V L的容器中充入a mol CO与2a mol H2,在催化剂作用下反应生成甲醇,平衡转化率与温度、压强的关系如右图所示。
①p1________p2(填“大于”、“小于”或“等于”);
②100 ℃时,该反应的化学平衡常数K=________(mol·L-1)-2;
③在其它条件不变的情况下,再增加a mol CO和2a molH2,达到新平衡时,CO的转化率________(填“增大”、“减小”或“不变”)。
(4)某科研小组用SO2为原料制取硫酸。
①利用原电池原理,用SO2、O2和H2O来制备硫酸,该电池用多孔材料作电极,它能吸附气体,同时也能使气体与电解质溶液充分接触。请写出该电池的负极的电极反应式________________。
②用Na2SO3溶液充分吸收SO2得NaHSO3溶液,然后电解该溶液可制得硫酸。电解原理示意图如下图所示。请写出开始时阳极反应的电极反应式________________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
氮是地球上含量丰富的一种元素,其单质及化合物在工农业生产、生活中有着重要作用。
(1)一定温度下,在1L容积恒定的密闭容器中充入2 mol N2和8molH2并发生反应。10min达平衡,测得氨气的浓度为0.4 mol·L-1,此时氮气的转化率为________。若想提高氨气的产率,根据化学平衡移动原理,提出合理的建议______________(写出一条即可)。
(2)如图是1mol NO2(g)和1mol CO(g)反应生成lmol CO2(g)和1 mol NO(g)过程中能量变化示意图,请写出该反应的热化学方程式_____________________。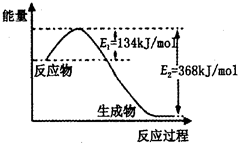
(3)在容积恒定的密闭容器中,进行如下反应:N2(g)+3H2(g) 2NH3(g) △H<0,其平衡常数K与温度T的关系如下表:
2NH3(g) △H<0,其平衡常数K与温度T的关系如下表: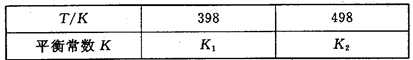
①该反应的平衡常数表达式:K=_____________;
②试判断K1__________K2(填写“>”“=”或“<”=;
③NH3(g)燃烧的方程式为:4NH3(g)+7O2(g)=4NO2(g)+6H2O(l),已知:
H2(g)+O2(g) 2H2O(l) △H=-483.6 kJ/mol
2H2O(l) △H=-483.6 kJ/mol
N2(g)+2O2(g) 2NO2(g) △H=+67.8 kJ/mol
2NO2(g) △H=+67.8 kJ/mol
N2(g)+3H2(g) 2NH3(g) △H=-92.0 kJ/mol
2NH3(g) △H=-92.0 kJ/mol
请计算NH3(g)的燃烧热________kJ/mol。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
SO2和NOx在化学工业上有重要用途,也是大气污染的主要来源,开发和利用并重,预防和治理并举是当前工业上和环境保护领域研究的主要课题之一。
(1)在接触法制硫酸的过程中,发生2SO2(g)+O2(g)  2SO3(g) △H<0反应,某温度下,SO2的平衡转化率(α)与体系总压强(p)的关系如下图所示,根据图示回答下列问题:
2SO3(g) △H<0反应,某温度下,SO2的平衡转化率(α)与体系总压强(p)的关系如下图所示,根据图示回答下列问题: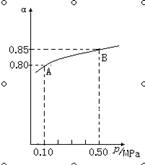
①平衡状态由A到B时,平衡常数K(A) K(B)(填“>”、“<”或“=”);
②将2.0molSO2和1.0molO2置于10L的密闭容器中,若40s后反应达到平衡,此时体系总压强为0.10MPa,这一段时间内SO2的平均反应速率为 。
该反应的平衡常数为 。
(2)用CH4催化还原NOx可消除氮的氧化物的污染,例如:CH4(g)+4NO2(g) = 4NO(g)+CO2(g)+2H2O(g) △H=-574kJ·mol—1
CH4(g)+4NO(g) = 2N2(g)+CO2(g)+2H2O(g) △H=-1160kJ·mol—1
取标准状况下4.48LCH4并使之完全反应:
①若将NO2还原至N2,整个过程中转移电子的物质的量为 ;
②若还原NO2和NO的混合物,放出的总热量Q的取值范围是 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(1)已知下列两个热化学方程式:
C3H8(g)+5O2(g) =3CO2(g)+4H2O(l) ΔH=-2220.0 kJ·mol-1
H2O(l)=H2O(g) ΔH="+44.0" kJ·mol-1
则0.5 mol丙烷燃烧生成CO2和气态水时释放的热量为___________ 。
(2)科学家已获得了极具理论研究意义的N4分子,其结构为正四面体(如下图所示),与白磷分子相似。已知断裂1molN—N键吸收193kJ热量,断裂1molN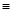 N键吸收941kJ热量,则1molN4气体转化为2molN2时要放出______________ kJ能量。
N键吸收941kJ热量,则1molN4气体转化为2molN2时要放出______________ kJ能量。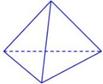
(3)阿波罗宇宙飞船上使用的是氢氧燃料电池,其电池总反应为:
2H2+O2=2H2O,电解质溶液为稀H2SO4溶液,电池放电时是将_________能转化为___________能。其电极反应式分别为:
负极_________________________,正极_____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(1)已知红磷比白磷稳定,又知:4P(白磷,s)+5O2(g)=2P2O5(s) △H1;
4P(红磷,s)+5O2(g)=2P2O5(s) △H2,则ΔH1和ΔH2的关系是△H1 △H2(填“>”、“<”
或“=”)。
(2)已知H2(g)和CH3OH(l)的燃烧热△H分别为-285.8kJ·mol-1和-726.5kJ·mol-1,写出由CO2
和H2生成液态甲醇和液态水的热化学方程式 。
(3)已知一定温度下,下列反应的平衡常数:SO2(g)+1/2O2(g)  SO3(g) K1,CO(g)+1/2O2(g)
SO3(g) K1,CO(g)+1/2O2(g)  CO2(g) K2。则相同温度下反应SO2(g)+CO2(g)
CO2(g) K2。则相同温度下反应SO2(g)+CO2(g)  SO3(g)+CO(g)的平衡常数为 。
SO3(g)+CO(g)的平衡常数为 。
(用K1、K2表示)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com