
| 选项 | 陈述Ⅰ | 陈述Ⅱ |
| A | SO2具有还原性 | SO2不能用浓硫酸干燥 |
| B | NH4Cl溶液和氨水均通过离子导电 | NH4Cl和NH3H2O均是强电解质 |
| C | “84”消毒液应保存在带玻璃塞的试剂瓶中 | “84”消毒液呈碱性 |
| D | 氧化铝用来制造耐火坩埚和耐高温的实验仪器 | 氧化铝的熔点很高 |
| A、A | B、B | C、C | D、D |


科目:高中化学 来源: 题型:
| A、乙酸具有酸性,乙醛中含有乙酸杂质,可加入氢氧化钠溶液洗涤、分液 | B、硫酸和氢氧化钠分别属于酸和碱,电解稀硫酸或氢氧化钠溶液的产物不同 | C、Fe3+有氧化性,FeCl3溶液可用于回收旧电路板中的铜 | D、浓硫酸具有吸水性,浓硫酸可用于干燥氨气 |
查看答案和解析>>
科目:高中化学 来源:广东省执信中学2011-2012学年高一上学期期中考试化学试题 题型:013
|
下列关于实验操作的陈述中正确的是 | |
| [ ] | |
A. |
受热后的蒸发皿要用坩埚钳夹取,并放在石棉网上冷却 |
B. |
稀释浓硫酸时,应在量筒中先加入一定量水,再沿器壁缓慢注入浓硫酸,并用玻璃棒搅拌 |
C. |
过滤时,为了加速溶液透过滤纸,可以用玻璃棒末端轻轻搅拌滤纸上的混合物 |
D. |
不慎将桌面上的酒精灯打翻引起小面积着火时,应迅速用水扑灭火 |
查看答案和解析>>
科目:高中化学 来源:四川省成都外国语学校2011-2012学年高一上学期期中考试化学试题 题型:021
|
下列关于实验操作的陈述中正确的是 | |
A. |
用规格为20 mL的量筒一次量取16 mL溶液,比用规格为10 mL的量筒分两次量取16 mL溶液的误差小 |
B. |
受热后的蒸发皿要用坩锅钳夹取,并放在石棉网上冷却 |
C. |
过滤时,为了加速溶液透过滤纸,可以用玻璃棒末端轻轻搅拌滤纸上的混合物 |
D. |
配制一定物质的量浓度溶液时,为了避免溶质的损失,直接把称量的固体溶质转移到容量瓶中 |
查看答案和解析>>
科目:高中化学 来源: 题型:
(12分)铁单质及其化合物在生活、生产中有广泛应用。请回答下列问题:
(1)黄铁矿(FeS2)是生产硫酸和冶炼钢铁的重要原料。其中一个反应为
3FeS2+8O2![]() 6SO2+Fe3O4,3 mol FeS2参加反应转移 mol电子。
6SO2+Fe3O4,3 mol FeS2参加反应转移 mol电子。
(2)氯化铁溶液常用作印刷电路铜板腐蚀剂,反应的离子方程式为________________________。从腐蚀废液回收得到金属铜还需要的试剂为___________________________________。
(3)与明矾相似,硫酸铁也可用作絮凝剂,在使用时发现硫酸铁并不能使酸性废水中的悬浮物沉降除去,其原因是 。
(4)下表中,对陈述I、II的正确性及其有无因果关系的判断都正确的是_____。(填字母)
选项 | 陈述I | 陈述II | 判断 |
A | 铁是地壳中含量最高的金属元素 | 铁是人类最早使用的金属材料 | I对;II对;有 |
B | 常温下铁与稀硫酸反应生成氢气 | 高温下氢气能还原氧化铁生成铁 | I对;II对;无 |
C | 铁属于过渡金属元素 | 铁和铁的某些化合物可以用作催化剂 | I错;II对;无 |
D | 铁在空气中表面生成致密氧化膜 | 可用铁罐储存运输浓硫酸、浓硝酸 | I对;II对;有 |
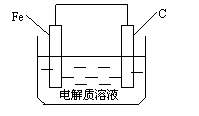 (5)钢铁的析氢腐蚀简单示意图如右,正极的电极反应式为 。该图某处稍作修改即可成为钢铁电化学防护的简单示意图,请直接在图中作出修改并标出电子流动方向。
(5)钢铁的析氢腐蚀简单示意图如右,正极的电极反应式为 。该图某处稍作修改即可成为钢铁电化学防护的简单示意图,请直接在图中作出修改并标出电子流动方向。
查看答案和解析>>
科目:高中化学 来源: 题型:
(12分)铁单质及其化合物在生活、生产中有广泛应用。请回答下列问题:
(1)黄铁矿(FeS2)是生产硫酸和冶炼钢铁的重要原料。其中一个反应为
3FeS2+8O2![]() 6SO2+Fe3O4,3 mol FeS2参加反应转移 mol电子。
6SO2+Fe3O4,3 mol FeS2参加反应转移 mol电子。
(2)氯化铁溶液常用作印刷电路铜板腐蚀剂,反应的离子方程式为________________________。从腐蚀废液回收得到金属铜还需要的试剂为___________________________________。
(3)与明矾相似,硫酸铁也可用作絮凝剂,在使用时发现硫酸铁并不能使酸性废水中的悬浮物沉降除去,其原因是 。
(4)下表中,对陈述I、II的正确性及其有无因果关系的判断都正确的是_____。(填字母)
选项 | 陈述I | 陈述II | 判断 |
A | 铁是地壳中含量最高的金属元素 | 铁是人类最早使用的金属材料 | I对;II对;有 |
B | 常温下铁与稀硫酸反应生成氢气 | 高温下氢气能还原氧化铁生成铁 | I对;II对;无 |
C | 铁属于过渡金属元素 | 铁和铁的某些化合物可以用作催化剂 | I错;II对;无 |
D | 铁在空气中表面生成致密氧化膜 | 可用铁罐储存运输浓硫酸、浓硝酸 | I对;II对;有 |
 (5)钢铁的析氢腐蚀简单示意图如右,正极的电极反应式为 。该图某处稍作修改即可成为钢铁电化学防护的简单示意图,请直接在图中作出修改并标出电子流动方向。
(5)钢铁的析氢腐蚀简单示意图如右,正极的电极反应式为 。该图某处稍作修改即可成为钢铁电化学防护的简单示意图,请直接在图中作出修改并标出电子流动方向。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com