
| A. | Ba(OH)2•8H2O晶体与氯化铵固体的反应 | |
| B. | 氢氧化钠溶液与盐酸反应 | |
| C. | 高温条件下碳粉与二氧化碳的反应 | |
| D. | 高温煅烧石灰石 |
分析 从化合价是否发生变化的角度判断是否氧化还原反应,化合价的升降为氧化还原反应的特征,反应物的总能量小于生成物的总能量,则反应为吸热反应.
解答 解:A.Ba(OH)2•8H2O晶体与NH4Cl固体的反应为吸热反应,但反应中各元素的化合价不变,所以不是氧化还原反应,故A错误;
B.氢氧化钠溶液与盐酸反应属于复分解反应,反应中各元素的化合价都不变,为非氧化还原反应,同时该反应是放热反应,故B错误;
C.高温条件下碳粉与二氧化碳的反应,该反应中碳元素的化合价发生变化,所以是氧化还原反应,同时该反应为吸热反应,故C正确;
D.煅烧石灰石为吸热反应,但反应中各元素的化合价不变,所以不是氧化还原反应,故D错误;
故选C.
点评 本题考查了氧化还原反应和吸热反应,明确元素化合价是解本题关键,难度不大.


 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案科目:高中化学 来源: 题型:解答题
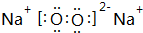 ,其中含有的化学键为离子键、共价键.
,其中含有的化学键为离子键、共价键.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | N 2为0.2 mol•L-1,H 2为0.6 mol•L-1 | |
| B. | N 2为0.15 mol•L-1 | |
| C. | N 2、H 2均为0.18 mol•L-1 | |
| D. | NH 3为0.4 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 离子 | K+ | Na+ | NH4+ | SO42- | NO3- | Cl- |
| 浓度/mol•L-1 | 4×10-6 | 6×10-6 | 2×10-5 | 4×10-5 | 3×10-5 | 2×10-5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2O2投入水中 | B. | 铜片投入到FeCl3溶液中 | ||
| C. | NaHCO3溶液和NaOH溶液混合 | D. | 过量氨水加入到AlCl3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 液氨作为清洁能源的反应原理是4NH3+5O2$→_{△}^{催化剂}$4NO+6H2O | |
| B. | 液氨可以作为溶剂使用,而氢的沸点极低,不易液化 | |
| C. | 氨气比空气轻,标准状况下密度约为0.76 g•L-1 | |
| D. | 氨气与氢气相比,优点在于氨气不容易发生爆炸,使用时更安全 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 取少量卤代烃加入NaOH水溶液共热,冷却,再加入AgNO3溶液检验卤代烃中卤原子的存在 | |
| B. | 除去乙烷中混有乙烯,将混合气体通入酸性高锰酸钾溶液 | |
| C. | 用燃烧的方法鉴别甲烷与乙炔 | |
| D. | 用溴水鉴别苯和甲苯 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 影响化学反应速率的因素很多,某课外兴趣小组用实验的方法进行探究.
影响化学反应速率的因素很多,某课外兴趣小组用实验的方法进行探究.| 实验步骤 | 现象 | 结论 |
| ①分别取等体积的2mol/L的硫酸于试管中;②分别投入大小、形状相同的Al、Fe、Mg | 反应快慢:Mg>Al>Fe | 反应物的性质越活泼,反应速率越快 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com