
【题目】硫﹣氨热化学循环制氢示意图如下: 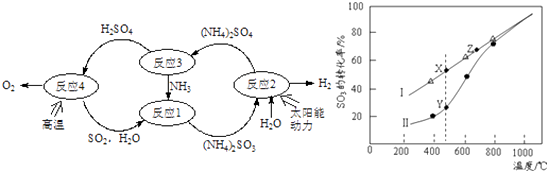
(1)反应1的离子方程式为 .
(2)反应2能量转化主要方式为 .
(3)反应3中控制反应条件很重要,不同条件下硫酸铵分解产物不同.若在400℃时分解,产物除水蒸气外还有A、B、C三种气体,A是空气中含量最多的单质,B能使湿润的红色石蕊试纸变蓝,C能使品红溶液褪色.则400℃时硫酸铵分解的化学方程式为 .
(4)反应4是由(a)、(b)两步反应组成:
H2SO4(l)=SO3(g)+H2O(g),△H=+177kJmol﹣1…(a)
2SO3(g)2SO2(g)+O2(g),△H=+196kJmol﹣1…(b)
①则H2SO4(l)分解为SO2(g)、O2(g)及H2O(g)的热化学方程式为: .
②在恒温密闭容器中,控制不同温度进行SO3分解实验.以SO3起始浓度均为cmolL﹣1 , 测定SO3的转化率,结果如图2,图中Ⅰ曲线为SO3的平衡转化率与温度的关系,Ⅱ曲线表示不同温度下反应经过相同反应时间且未达到化学平衡时SO3的转化率.
(i)图中点X与点Z的平衡常数K:
K(X)K(Z)(选填:>,<,=);
(ii)Y点对应温度下的反应速率:
v(正)v(逆)(选填:>,<,=);
(iii)随温度的升高,Ⅱ曲线逼近Ⅰ曲线的原因是: .
【答案】
(1)SO2+H2O+2NH3=2NH4++SO32﹣
(2)太阳能转化为电能再转化为化学能
(3)3(NH4)2SO4 ![]() 4NH3↑+N2↑+3SO2↑+6H2O↑
4NH3↑+N2↑+3SO2↑+6H2O↑
(4)2H2SO4(l)?2SO2(g)+O2(g)+2H2O(g)△H=+550kJ?mol﹣1;<;>;温度升高,反应速率加快,达到平衡所需的时间缩短(或温度升高,反应速率加快,相同时间内更快达到平衡)
【解析】解:(1)反应1是二氧化硫和氨气在水中反应生成亚硫酸铵的反应,反应的离子方程式为SO2+H2O+2NH3=2NH4++SO32﹣ , 所以答案是:SO2+H2O+2NH3=2NH4++SO32﹣;(2.)据图分析,反应2是太阳能转化为电能,电解亚硫酸铵生成硫酸铵和氢气,所以答案是:太阳能转化为电能再转化为化学能;
(3.)硫酸铵在400℃时分解,产物除水蒸气外还有A、B、C三种气体,A是空气中含量最多的单质,则为氮气,B能使湿润的红色石蕊试纸变蓝,为氨气,C能使品红溶液褪色,为二氧化硫,反应的化学方程式为3(NH4)2SO4 ![]() 4NH3↑+N2↑+3SO2↑+6H2O↑,所以答案是:3(NH4)2SO4
4NH3↑+N2↑+3SO2↑+6H2O↑,所以答案是:3(NH4)2SO4 ![]() 4NH3↑+N2↑+3SO2↑+6H2O↑;
4NH3↑+N2↑+3SO2↑+6H2O↑;
(4.)①已知H2SO4(l)=SO3(g)+H2O(g),△H=+177kJmol﹣1…(a)
2SO3(g)2SO2(g)+O2(g),△H=+196kJmol﹣1…(b)
据盖斯定律,2a+b得:2H2SO4(l)2SO2(g)+O2(g)+2H2O(g)△H=+550kJmol﹣1 ,
所以答案是:2H2SO4(l)2SO2(g)+O2(g)+2H2O(g)△H=+550kJmol﹣1;
②i)据图可知,随温度的升高,三氧化硫的平衡转化率增大,说明三氧化硫分解是吸热反应,温度越高,平衡常数越大,所以K(X)<K(Z),所以答案是:<;
ii)Y点时反应还没有达到平衡状态,正向进行,所以正反应速率大于逆反应速率,所以答案是:>;
iii)温度的升高,曲线b向曲线a逼近,反应速率加快,达到平衡时的时间缩短,
所以答案是:温度升高,反应速率加快,达到平衡所需的时间缩短(或温度升高,反应速率加快,相同时间内更快达到平衡).
【考点精析】掌握化学平衡状态本质及特征是解答本题的根本,需要知道化学平衡状态的特征:“等”即 V正=V逆>0;“动”即是动态平衡,平衡时反应仍在进行;“定”即反应混合物中各组分百分含量不变;“变”即条件改变,平衡被打破,并在新的条件下建立新的化学平衡;与途径无关,外界条件不变,可逆反应无论是从正反应开始,还是从逆反应开始,都可建立同一平衡状态(等效).


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下列各组物质不属于同系物的是( ) ①CH2﹣CH﹣COOH和C17H33COOH
② 
③正丁烷和2,2﹣二甲基丙烷
④CH3CH2CHO和 ![]()
A.①③
B.①④
C.②③
D.②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中,不属于氧化还原反应的是( )
A.H2+F2═2HF
B.3CO+Fe2O3 ![]() ?2Fe+3CO2
?2Fe+3CO2
C.NaOH+HCl═NaCl+H2O
D.4HNO3 ![]() ?2H2O+4NO2↑+O2↑
?2H2O+4NO2↑+O2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碘是人体不可缺少的元素,为了防止碘缺乏,现在市场上流行一种加碘盐,就是在精盐中添加一定量的KIO3进去.某研究小组为了检测某加碘盐中是否含有碘,查阅了有关的资料,发现其检测原理是:在溶液中 KIO3+5KI+3H2SO4=3I2+3H2O+3K2SO4
(1)用双线桥表示该反应中电子转移的方向和数目:该反应中氧化产物与还原产物的质量比是 , 0.1mol KIO3参加反应时转移电子mol
(2)实验结束后分离I2和K2SO4溶液所用的试剂是 A.Na2SO4溶液B.酒精 C. CCl4 D.食盐水
所用的分离方法是 , 所用仪器是 , 你怎么判断该食盐中是否含碘 .
(3)上面实验中用到一定物质的量浓度的稀硫酸,若配制1mol/L的稀硫酸溶液480mL,需用18mol/L浓H2SO4mL,配制中需要用到的主要玻璃仪器是(填序号) . A.100mL量筒 B.托盘天平 C.玻璃棒D.100mL容量瓶 E.50mL 量筒 F.胶头滴管 G.烧杯 H.500mL容量瓶
(4)下面操作造成所配稀硫酸溶液浓度偏高的是
A.溶解后溶液没有冷却到室温就转移
B.转移时没有洗涤烧杯、玻璃棒
C.向容量瓶加水定容时眼睛俯视液面
D.用量筒量取浓硫酸后洗涤量筒并把洗涤液转移到容量瓶
E.摇匀后发现液面低于刻度线,又加蒸馏水至刻度线.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时加水稀释10mL pH=11的氨水,下列判断正确的是( )
A.原氨水的浓度为10﹣3mol?L﹣1
B.溶液中 ![]() 减小
减小
C.氨水的电离程度增大,溶液中所有离子的浓度均减小
D.再加入10 mL pH=3的盐酸充分反应后混合液的pH值肯定大于7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Cu(OH)2在水中存在着如下溶解平衡:Cu(OH)2 (s)Cu2+(aq)+2OH﹣ (aq),在常温下Ksp[Cu(OH)2]=2×10﹣20 . 某CuSO4溶液中,c(Cu2+)=0.02molL﹣1 , 在常温下要生成Cu(OH)2沉淀,需要向CuSO4溶液中加入碱溶液来调节溶液的pH,使溶液的pH大于( )
A.2
B.3
C.4
D.5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,用浓度为0.1000molL﹣1 NaOH溶液分别滴定20.00mL浓度均为0.1000molL﹣1的三种酸HX、HY、HZ,滴定曲线如图所示.下列说法正确的是( ) 
A.相同浓度时,三种酸的酸性强弱顺序是:HX>HY>HZ
B.根据滴定曲线可得,Ka(HX)=10﹣3 molL﹣1
C.滴定HY,V(NaOH)=20 mL时,c(Na+)=c(Y﹣)>c(OH﹣)=c(H+)
D.滴定HZ,V(NaOH)=15 mL时,c(Z﹣)>c(Na+)>c(H+)>c(OH﹣)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组同学利用氧化还原反应:2KMnO4+10FeSO4+8H2SO4=2MnSO4+5Fe2(SO4)3+K2SO4+8H2O设计如下原电池,盐桥中装有饱和溶液.下列说法正确的是( ) 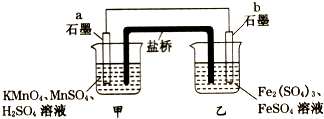
A.a电极上发生的反应为:MnO4﹣+8H++5e﹣═Mn2++4H2O
B.外电路电子的流向是从a到b
C.电池工作时,盐桥中的SO42﹣移向甲烧杯
D.b电极上发生还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,可逆反应X(g)+3Y(g)2Z(g),若X,Y,Z起始浓度分别为c1、c2、c3(均不为0,单位mol/L),当达平衡时X,Y,Z的浓度分别为0.1mol/L,0.3mol/L,0.08mol/L,则下列判断不合理的是( )
A.c1:c2=1:3
B.平衡时,Y和Z的生成速率之比为3:2
C.X,Y的转化率不相等
D.c1的取值范围为0<c1<0.14mol/L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com