
分析 (1)已知:①N2(g)+O2(g)═2NO(g)△H=+180.5kJ•mol-1
②4NH3(g)+5O2(g)═4NO(g)+6H2O(g)△H=-905kJ•mol-1
③2H2(g)+O2(g)═2H2O(g)△H=-483.6kJ•mol-1
则反应N2(g)+3H2(g)═2NH3(g)可以是①+③×$\frac{3}{2}$-②×$\frac{1}{2}$得到,热量也进行相应的计算;
(2)平衡常数只与温度有关,催化剂不能改变平衡状态,根据影响化学平衡移动的因素以及影响化学平衡常数的因素来回答;
(3)氨水可以和盐酸之间发生反应得到氯化铵溶液,根据离子浓度大小比较方法来回答;
(4)氨水可以和氯化铝之间反应生成氢氧化铝,氢氧化铝可以和强碱之间反应,向含铝离子的溶液中加入氢氧化钠的过程中,依次发生的反应是:Al3++3OH-=Al(OH)3↓,Al(OH)3+NaOH=NaAlO2+2H2O,根据化学反应方程式来回答.
解答 解:(1)已知:①N2(g)+O2(g)═2NO(g)△H=+180.5kJ•mol-1
②4NH3(g)+5O2(g)═4NO(g)+6H2O(g)△H=-905kJ•mol-1
③2H2(g)+O2(g)═2H2O(g)△H=-483.6kJ•mol-1
则反应N2(g)+3H2(g)═2NH3(g)可以是①+③×$\frac{3}{2}$-②×$\frac{1}{2}$得到,
所以该反应的△H=180.5kJ•mol-1+(-483.6kJ•mol-1)×$\frac{3}{2}$-(-905kJ•mol-1)×$\frac{1}{2}$=-92.4kJ/mol,
故答案为:N2(g)+3H2(g)═2NH3(g)△H=-92.4kJ/mol;
(2)平衡常数只与温度有关,催化剂不能改变平衡状态,增大反应物浓度化学平衡正向移动,增大压强,化学平衡向着气体系数和减小的方向移动,
故答案为:①②;
(3)将相同体积、pH之和为14的氨水和盐酸混合后,所得的溶液是氯化铵和氨水的混合物,
溶液中离子浓度由大到小的顺序为c(NH4+)>c(Cl-)>c(OH-)>c(H+),
故答案为:c(NH4+)>c(Cl-)>c(OH-)>c(H+);
(4)氨水和硫酸铝溶液来制备一定量的氢氧化铝的实质是:Al3++3NH3•H2O=Al(OH)3↓+3NH4+,40mL 0.5mol/L即0.02mol硫酸铝溶液生成沉淀量最大时,对应的氢氧化铝物质的量是0.02mol,质量是1.56g,若氢氧化铝的质量为0.78克时,有两种情况:
①氢氧化钠量少,铝离子有剩余,此时按照方程式Al3++3OH-=Al(OH)3↓进行反应,氢氧化铝的质量为0.78克即0.01mol时,消耗氢氧化钠是0.03mol,所以体积是0.015L;
②氢氧化钠过量,沉淀量达到最大后又被溶解了一部分,
Al3++3OH-=Al(OH)3↓,Al(OH)3+NaOH=NaAlO2+2H2O
1 3 1 1 1
0.02mol 0.06mol 0.02mol 0.01mol 0.01mol
所滴加氢氧化钠溶液的物质的量为:0.06mol+0.01mol=0.07mol,所以体积是0.035L,
故答案为:15ml或35ml.
点评 本题是一道综合知识的考查题,涉及热化学、化学平衡移动等方面知识,考查学生分析和解决问题的能力,综合性强,难度大.


 教材全解字词句篇系列答案
教材全解字词句篇系列答案科目:高中化学 来源: 题型:选择题
| A. | 上述过程中,最终被还原的是NO3- | |
| B. | 从上述过程中可以得出结论,氧化性:HNO3>稀H2SO4>Fe3+ | |
| C. | 上述过程中,会产生一种无色无味的难溶于水的气体 | |
| D. | 若通入的SO2完全反应,则同温同压下,SO2和逸出气体的体积为3:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 水的电离平衡曲线如图所示,若以A点表示25℃时水的电离达平衡时的离子浓度,B点表示100℃时水的电离达平衡时的离子浓度,则下列说法正确的是( )
水的电离平衡曲线如图所示,若以A点表示25℃时水的电离达平衡时的离子浓度,B点表示100℃时水的电离达平衡时的离子浓度,则下列说法正确的是( )| A. | 改变条件使纯水的pH值减小,其酸性增强 | |
| B. | 100℃时某溶液中由水电离产生的c(H+)=1×10-11 mol•L-1,则该溶液的pH可能是11或3 | |
| C. | 将pH=9的Ba(OH)2溶液与pH=4的稀盐酸混合,并保持100℃的恒温,混合溶液的pH=7,则Ba(OH)2溶液和盐酸的体积比为10:1 | |
| D. | 100℃时,pH值均为8的醋酸钠和氨水两溶液中,水的电离程度之比为104:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
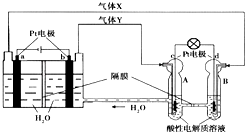 空间实验室“天宫一号”的供电系统中有再生氢氧燃料电池(RFC),RFC是一种将水电解技术与氢氧燃料电池技术相结合的可充电电池.如图为RFC工作原理示意图,有关说法正确的是( )
空间实验室“天宫一号”的供电系统中有再生氢氧燃料电池(RFC),RFC是一种将水电解技术与氢氧燃料电池技术相结合的可充电电池.如图为RFC工作原理示意图,有关说法正确的是( )| A. | 当有0.1mol电子转移时,a极产生1.12L O2(标况) | |
| B. | b极上发生的电极反应是:2H++2e-═H2↑ | |
| C. | d极上发生的电极反应是:O2+4H++4e-═2H2O | |
| D. | c极上进行还原反应,B中的H+可以通过隔膜进入A |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
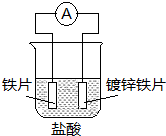
| A. | 溶液中pH值明显下降 | B. | 阴极的电极反应式:Fe-2e→Fe2+ | ||
| C. | 铁片为正极,镀锌铁片为负极 | D. | 电子由锌经溶液流向铁 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
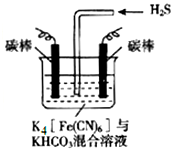 [Fe(CN)6]3-可将气态废弃物中的硫化氢转化为可利用的硫,自身还原为[Fe(CN)6]4-.工业上常采用如图所示的电解装置,通电电解,然后通入H2S加以处理.下列说法不正确的是( )
[Fe(CN)6]3-可将气态废弃物中的硫化氢转化为可利用的硫,自身还原为[Fe(CN)6]4-.工业上常采用如图所示的电解装置,通电电解,然后通入H2S加以处理.下列说法不正确的是( )| A. | 整个过程中需要不断补充K4[Fe(CN)6]与KHCO3 | |
| B. | 电解时阴极反应式为:2HCO3-+2 e-═H2↑+2CO32- | |
| C. | 当电解过程中有22.4L标准状况下的H2生成时,溶液中有32gS析出(溶解忽略不计) | |
| D. | 电解时阳极反应式为[Fe(CN)6]4--e-═[Fe(CN)6]3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯碱工业是电解熔融的NaCl,阳极产生Cl2 | |
| B. | 氢氧燃料电池可将热能直接转化为电能 | |
| C. | 原电池工作时,电子从负极经外电路移向正极 | |
| D. | 工业上电解熔融的AlCl3来制取铝 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
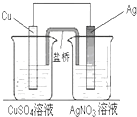 用铜片、银片、CuSO4溶液、AgNO3溶液、导线和盐桥(装有琼脂-KNO3的U形管)构成一个原电池(如图).以下有关该原电池的叙述正确的是 ( )
用铜片、银片、CuSO4溶液、AgNO3溶液、导线和盐桥(装有琼脂-KNO3的U形管)构成一个原电池(如图).以下有关该原电池的叙述正确的是 ( )| A. | ①② | B. | ③④ | C. | ①②④ | D. | ①②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
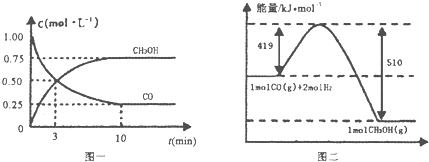
| 容器 | 反应物投入的量 | 反应物的转化率 | CH3OH的浓度 | 能量变化 (Q1,Q2,Q3均大于0) |
| 甲 | 1mol CO和2mol H2 | a1 | c1 | 放出Q1kJ热量 |
| 乙 | 1mol CH3OH | a2 | c2 | 吸收Q2kJ热量 |
| 丙 | 2mol CO和4mol H2 | a3 | c3 | 放出Q3kJ热量 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com