
【题目】已知反应2NO(g)+2H2(g)![]() N2(g)+2H2O(g) △H=-752kJ·mol-1的反应机理如下:
N2(g)+2H2O(g) △H=-752kJ·mol-1的反应机理如下:
①2NO(g)![]() N2O2(g) (快)
N2O2(g) (快)
②N2O2(g)+H2(g)![]() N2O(g)+H2O(g) (慢)
N2O(g)+H2O(g) (慢)
③N2O(g)+H2(g)![]() N2(g)+H2O(g) (快)
N2(g)+H2O(g) (快)
下列有关说法错误的是
A. ①的逆反应速率大于②的正反应速率
B. ②中N2O2与H2的碰撞仅部分有效
C. N2O2和N2O是该反应的催化剂
D. 总反应中逆反应的活化能比正反应的活化能大
 同步轻松练习系列答案
同步轻松练习系列答案 课课通课程标准思维方法与能力训练系列答案
课课通课程标准思维方法与能力训练系列答案科目:高中化学 来源: 题型:
【题目】C、N、S和Cl元素的单质及化合物在工业生产中的有效利用备受关注。请回答下列问题:
(1)已知:I.2SO2(g)+O2(g)+2H2O(1) =2H2SO4(aq) △H1;
Ⅱ.Cl2(g)+H2O(1)![]() HCl(aq)+HClO(aq) △H2;
HCl(aq)+HClO(aq) △H2;
Ⅲ.2HClO(aq) =2HCl(aq)+O2(g) △H3
SO2(g)+Cl2(g)+2H2O(1)=2HCl(aq)+H2SO4 (aq) △H4=__________(用含有△H1、△H2和△H3的代数式表示)。
(2)25℃时,H2SO3溶液中各含硫微粒的物质的量分数(δ)与溶液pH的变化关系如图所示。
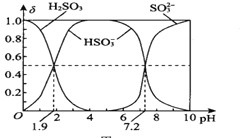
已知25℃时,NaHSO3的水溶液pH<7,用图中的数据通过计算解释原因 ____________________。
(3)利用“ Na-CO2”电池将CO2变废为宝。我国科研人员研制出的可充电“ Na-CO2”电池,以钠箔和多壁碳纳米管(MWCNT)为电极材料,总反应为4Na+3CO2![]() 2Na2CO3+C。放电时该电池“吸入”CO2,其工作原理如图所示:
2Na2CO3+C。放电时该电池“吸入”CO2,其工作原理如图所示:
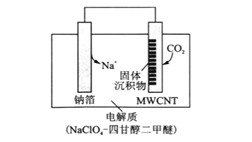
①放电时,正极的电极反应式为______。
②选用高氯酸钠—四甘醇二甲醚做电解液的优点是_______(至少写两点)。
(4)氯氨是氯气遇到氨气反应生成的一类化合物,是常用的饮用水二级消毒剂,主要包括一氯胺、二氯胺和三氯胺(NH2C1、NHC12和NC13),副产物少于其它水消毒剂。
①一氯胺(NH2Cl)的电子式为_______。一氯胺是重要的水消毒剂,其原因是由于一氯胺在中性、酸性环境中会发生水解,生成具有强烈杀菌作用的物质,该反应的化学方程式为_______。
②在恒温条件下,2molCl2和1molNH3发生反应2Cl2(g)+NH3(g)![]() NHCl2(l)+2HCl(g),测得平衡时Cl2和HCl的物质的量浓度与平衡总压的关系如图所示:
NHCl2(l)+2HCl(g),测得平衡时Cl2和HCl的物质的量浓度与平衡总压的关系如图所示:
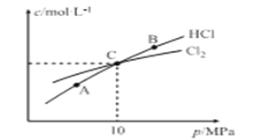
计算C点时该反应的压强平衡常数Kp(C)= _______ (Kp是平衡分压代替平衡浓度计算,分压=总压×物质的量分数)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国地大物博、资源丰富,其中山西的煤、大庆的石油,四川的天然气较为出名。下列有关化石能源叙述正确的是
A.煤的干馏为化学变化B.汽油为纯净物
C.天然气为二次能源D.裂化的目的是提高乙烯产量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A、B、C三种可溶性正盐,阴、阳离子各不相同,其阴离子的摩尔质量依次增大(按A、B、C的顺序),将等物质的量的A、B、C溶于水,所得溶液中只含有Fe3+、K+、SO![]() 、NO
、NO![]() 、Cl-五种离子,同时生成一种白色沉淀。
、Cl-五种离子,同时生成一种白色沉淀。
请回答下列问题:
(1)经检验,三种正盐中还含有下列选项中的一种离子,该离子是 。
A.Na+ B.Mg2+ C.Cu2+ D.Ag+
(2)三种正盐的化学式分别是:A ,B ,C 。
(3)若将A、B、C三种正盐按一定比例溶于水后,所得溶液中只含有Fe3+、SO![]() 、NO
、NO![]() 、K+四种离子且物质的量之比依次为1∶2∶3∶4,则A、B、C三种正盐的物质的量之比为 。
、K+四种离子且物质的量之比依次为1∶2∶3∶4,则A、B、C三种正盐的物质的量之比为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据如下能量关系示意图,下列说法正确的是

A. 1 mol C(g)与1 mol O2(g)的能量之和为393.5 kJ
B. 反应2CO(g)+O2(g) ==2CO2(g)中,生成物的总能量大于反应物的总能量
C. 由C→CO的热化学方程式为:2C(s)+O2(g) ==2CO(g) ΔH= 221.2 kJmol1
D. 热值指一定条件下单位质量的物质完全燃烧所放出热量,则CO热值ΔH= 10.1 kJmol1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Li/Li2O体系的能量循环图如图所示。下列说法正确的是

A. △H3<0 B. △H3+△H4+△H5=△H6
C. △H6>△H5 D. △H1+△H2+△H3+△H4+△H5+△H6=0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,把 2.5 mol A 和 2.5 mol B混合盛入容积为 2 L的密闭容器里,发生如下反应: 3A(g)+B(g) ![]() x C(g) + 2D(g), 经 5 s反应达平衡,在此 5 s 内 C的平均反应速率为 0.2 mol·L-1·s-1,同时生成1 mol D,下列叙述中不正确的是
x C(g) + 2D(g), 经 5 s反应达平衡,在此 5 s 内 C的平均反应速率为 0.2 mol·L-1·s-1,同时生成1 mol D,下列叙述中不正确的是
A. x=4
B. 达到平衡状态时 A 的物质的量浓度为 c(A)=1.0 mol·L-1
C. 5s 内 B的反应速率 v(B)=0.05 mol·(L·s)-1
D. 达到平衡状态时容器内气体的压强与起始时压强比为 6:5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于常温下pH=12的稀氨水,下列叙述不正确的是
A. 溶液中c (OH-)=1.010-2 mol·L-1
B. 由水电离出的c (OH-)=1.010-12 mol·L-1
C. 加水稀释后,氨水的电离程度增大
D. 加入少量NH4Cl固体,溶液pH变大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com