
| A.F2+H2=2HF | B.Cl2+H2=2HCl |
| C.Br2+H2=2HBr | D.I2+H2=2HI |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:不详 题型:填空题
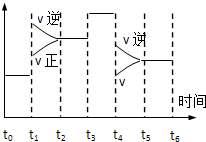
查看答案和解析>>
科目:高中化学 来源:不详 题型:多选题
| A.加入蒸馏水 | B.加热 |
| C.加入NaCl溶液 | D.加入浓盐酸 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.粗锌与稀硫酸反应制氢气比纯锌快,是因为粗锌比纯锌还原性强 |
| B.催化剂不影响反应活化能,从而只影响反应速率,不影响化学平衡 |
| C.向包有Na2O2的脱脂棉吹气后脱脂棉燃烧,说明CO2、H2O与Na2O2反应是放热反应 |
| D.强电解质水溶液的导电性一定大于弱电解质水溶液的导电性 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.增加水的量或温度,可以加快镁跟水的反应速率 |
| B.硫酸的浓度越大,锌与硫酸反应制取氢气的速率就越大 |
| C.对反应3H2(g)+N2(g)?2NH3(g),在密闭容器中进行(固定体积),若充入氦气,则压强增大,化学反应速率加快 |
| D.对反应3H2(g)+N2(g)?2NH3(g),使用催化剂,正逆反应速率同等程度加快 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
| 负极材料 | 正极材料 | 负极反应式 | 正极反应式 | 电解质溶液 | |
| 实验三 | Zn | 杂质 | Zn-2e-=Zn2+ | 2H++2e-=H2↑ | 盐酸 |
| 实验四 | Zn | Cu | Zn-2e-=Zn2+ | 2H++2e-=H2↑ | 盐酸 |
| 负极材料 | 正极材料 | 负极反应式 | 正极反应式 | 电解质溶液 | |
| 实验三 | Zn | 杂质 | Zn-2e-=Zn2+ | 2H++2e-=H2↑ | 盐酸 |
| 实验四 | Zn | Cu | Zn-2e-=Zn2+ | 2H++2e-=H2↑ | 盐酸 |

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| 高温 |
| A.一定条件下,任何可逆反应的进程都有一定的限度,所以CO不可能完全转化 |
| B.尾气中CO的比例不变,说明反应达到了这一条件下的化学平衡状态 |
| C.尾气中CO的比例不变,是因为CO的消耗速率与CO生成速率相等 |
| D.CO是气体,铁矿石(主要成分Fe2O3)是固体,CO与铁矿石接触不充分 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com