
【题目】Ⅰ.某化学兴趣小组用FeCl2(用铁粉与盐酸反应制得)和NH4HCO3制备FeCO3的装置如图所示。回答下列问题:
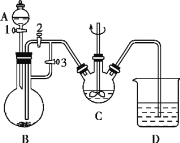
(1)C仪器的名称是___,FeCO3在其中生成,该装置中发生的主要反应的离子方程式为___。
(2)实验时首先打开活塞3,关闭活塞2,再打开活塞1向B中滴加盐酸,其目的是___,关闭活塞1,一段时间后,再关闭活塞___打开活塞__,使B装置中气压增大,将B装置中的氯化亚铁溶液压入C中。
Ⅱ.乳酸亚铁晶体((CH3CH(OH)COO)2Fe·3H2O,Mr =288g/mol)是常用的补铁剂。乳酸亚铁可由乳酸与碳酸亚铁反应制得。
(3)将制得的FeCO3加入乳酸溶液中,再加入过量铁粉,75℃下搅拌使之充分反应,结束后,无需过滤,除去过量铁粉的反应方程式为2CH3CH(OH)COOH+Fe=(CH3CH(OH)COO)2Fe+H2↑;从上述所得溶液中获得乳酸亚铁晶体的方法是____、过滤、洗涤、干燥。
(4)该兴趣小组用KMnO4测定产品中亚铁含量进而计算乳酸亚铁晶体的质量分数。发现产品的质量分数总是大于100%,其原因可能是___。
经查阅文献后,该兴趣小组改用铈(Ce)量法测定产品中Fe2+的含量。取2.880g产品配成100mL溶液,每次取20.00mL,进行必要处理,用0.1000mol·L-1的Ce(SO4)2标准溶液滴定至终点,平均消耗Ce(SO4)2标准溶液19.70mL。滴定反应为Ce4++Fe2+=Ce3++Fe3+,则产品中乳酸亚铁晶体的质量分数为____。
【答案】三颈烧瓶 Fe2++2HCO3-=FeCO3↓+CO2↑+H2O 排出装置中的空气,防止Fe2+被氧化 3 2 蒸发浓缩、冷却结晶 乳酸根离子中含有羟基,也能被酸性高锰酸钾溶液氧化 98.5%
【解析】
(1)C是三颈烧瓶,FeCl2和NH4HCO3反应生成FeCO3的离子方程式为Fe2++2HCO3-=FeCO3↓+CO2↑+H2O;故答案为:三颈烧瓶,Fe2++2HCO3-=FeCO3↓+CO2↑+H2O;
(2)实验时首先打开活塞3,关闭活塞2,再打开活塞1向B中滴加盐酸,盐酸和铁反应生成FeCl2和氢气,利用氢气排出装置中的空气,防止Fe2+被氧化;
(3)乳酸亚铁晶体((CH3CH(OH)COO)2Fe·3H2O)带有结晶水,从溶液中获得结晶水合物不能直接加热蒸干,会失去结晶水,应采用蒸发浓缩、冷却结晶、过滤、洗涤、干燥的方法获得;故答案为:蒸发浓缩、冷却结晶;
(4)乳酸根离子中含有羟基,也能被酸性高锰酸钾溶液氧化,导致消耗的高锰酸钾增多,计算出的乳酸亚铁晶体的质量分数会大于100%。用铈(Ce)量法测定产品中Fe2+的含量的实验中,消耗n(Ce4+)=0.01970L×0.1000mol·L-1=1.970×10-3mol,根据滴定反应, n(Fe2+)= n[(CH3CH(OH)COO)2Fe·3H2O] = n(Ce4+)=1.970×10-3mol,在100 mL溶液里,n[(CH3CH(OH)COO)2Fe·3H2O]= 1.970×10-3×5mol,所以m[(CH3CH(OH)COO)2Fe·3H2O]= 1.970×10-3mol×5×288g/mol=1.970×10-3×5×288g,则产品中乳酸亚铁晶体的质量分数为![]() =98.5%;故答案为:乳酸根离子中含有羟基,也能被酸性高锰酸钾溶液氧化,98.5%。
=98.5%;故答案为:乳酸根离子中含有羟基,也能被酸性高锰酸钾溶液氧化,98.5%。


 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案科目:高中化学 来源: 题型:
【题目】下列各组微粒的空间构型相同的是( )
①NH3和H2O ②NH4+和H3O+ ③NH3和H3O+ ④O3和SO2 ⑤CO2和C2H2 ⑥SiO44—和SO42—
A. 全部B. 除①④⑥以外C. ③④⑤⑥D. ②⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】当1,3-丁二烯和溴单质1:1加成时,其反应机理及能量变化如下:
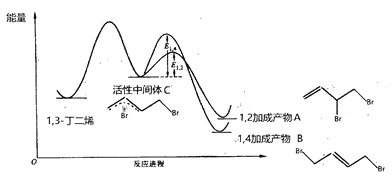
不同反应条件下,经过相同时间测得生成物组成如下表:

下列分析不合理的是
A. 产物A、B互为同分异构体,由中间体生成A、B的反应互相竞争
B. 相同条件下由活性中间体C生成产物A的速率更快
C. 实验1测定产物组成时,体系己达平衡状态
D. 实验1在t min时,若升高温度至25℃,部分产物A会经活性中间体C转化成产物B
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】取44.2g碳酸钠和碳酸氢钠的混合粉末样品,将其分成两等份,取其中一份加热到质量不再改变,冷却后称其质量为15.9g;另一份溶于水,配成500mL溶液。试计算(计算结果用小数形式表示):
(1)原样品中碳酸氢钠的物质的量为_____mol。
(2)所配溶液中Na+的物质的量浓度为______mol·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于![]() (I)、
(I)、![]() (II)、
(II)、![]() (III)、
(III)、![]() (IV)化合物的说法正确的是
(IV)化合物的说法正确的是
A. Ⅰ、Ⅱ、Ⅲ、Ⅳ的沸点依次升高 B. Ⅰ、Ⅲ的一氯代物均只有四种
C. Ⅱ、Ⅲ中碳原子可能都处于同一平面 D. Ⅲ、Ⅳ都属于芳香族化合物,互为同系物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】美籍华裔科学家钱永键、日本科学家下修村和美国科学家马丁·沙尔菲因在发现和研究绿色荧光蛋白(GFP)方面做出突出贡献而分享了2008年诺贝尔化学奖。经研究发现GFP中的生色基团结构如图所示,下列有关GFP的说法中正确的是( )
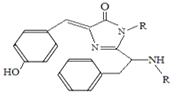
A. 该有机物属于芳香烃
B. 该有机物能发生加成反应和氧化反应
C. 1mol该有机物分子中含有7mol碳碳双键
D. 该有机物所有原子都有可能共平面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如下图所示装置可以用来发生、洗涤、干燥、收集 (不考虑尾气处理)气体。该装置可用于:
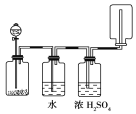
A.锌和盐酸生成氢气B.二氧化锰和浓盐酸生成氯气
C.碳酸钙和盐酸生成二氧化碳D.KClO3和MnO2生成氧气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氟碳铈矿(主要成分为CeFCO3)是提取稀土化合物、冶炼铈的重要矿物原料,以氟碳铈矿为原料提取铈的工艺流程如图所示。回答下列问题:

(1)CeFCO3中Ce的化合价为___________。
(2)氧化培烧时不能使用陶瓷容器,原因是_____________________________________。
(3)氧化焙烧后的产物之一为CeO2,则酸浸时发生反应的离子方程式为____________。
(4)HT是一种难溶于水的有机溶剂,则操作Ⅰ的名称为_________。
(5)为了提高酸浸率,可以适当提高反应温度,但温度偏高浸出率反而会减小,其原因是_______________________________________。
(6)有机物HT能将Ce3+从水溶液中提取出来,该过程可表示为Ce3+ (水层)+3HT(有机层) ![]() CeT3 (有机层)+3H+ (水层)。向CeT3(有机层)中加入稀硫酸能获得较纯的含Ce3+水溶液,从平衡角度解释其原因:___________________________________。
CeT3 (有机层)+3H+ (水层)。向CeT3(有机层)中加入稀硫酸能获得较纯的含Ce3+水溶液,从平衡角度解释其原因:___________________________________。
(7)已知,298K时,Ksp[Ce(OH)3]=5×l0-20,若溶液中c(Ce3+)=0.05mol·L-1,加碱调节pH到_________时Ce3+开始沉淀(忽略加碱过程中溶液体积变化)。
(8) 写出向Ce(OH)3悬浊液中通入氧气得到产品Ce(OH)4的化学方程式:___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某无色溶液中可能含有Na+、K+、NH4+、Mg2+、Cu2+、SO42-、SO32-、Cl-、Br-、CO32-中的若干种,离子浓度都为0.1mol·L-1。往该溶液中加入过量的BaCl2和盐酸的混合溶液,无白色沉淀生成。某同学另取少量原溶液,设计并完成如下实验:

则关于原溶液的判断不正确的是
A.若步骤中Ba(NO3)2和HNO3溶液改用BaCl2和盐酸的混合溶液,则对溶液中离子的判断无影响
B.无法确定原溶液中是否存在Cl-
C.肯定存在的离子是SO32-、Br-,是否存在Na+、K+需要通过焰色反应来确定
D.肯定不存在的离子是Mg2+、Cu2+、SO42-、CO32-,是否含NH4+另需实验验证
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com