
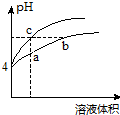
 某温度下,体积和pH都相同的氯化铵溶液和盐酸加水稀释时的pH变化曲线如图所示.下列判断正确的是( )
某温度下,体积和pH都相同的氯化铵溶液和盐酸加水稀释时的pH变化曲线如图所示.下列判断正确的是( )| A. | a、c两点溶液的导电能力:c>a | |
| B. | a、b、c三点溶液中水的电离程度:a>b>c | |
| C. | b点溶液中:c(H+)=c(Cl-)+c(OH-) | |
| D. | 用NaOH溶液和等体积b、c处溶液反应,消耗NaOH溶液的体积Vb=Vc |
分析 盐酸是强酸,完全电离,氯化铵是能水解的盐,水解显示酸性,加水稀释后水解程度增大,
A.溶液的导电能力和溶液中自由移动离子的多少有关;
B.盐酸对水的电离起抑制作用,氯化铵对水的电离起到促进作用;
C.根据溶液中的质子守恒分析;
D.b点为铵根水解导致溶液呈酸性,b点溶液中铵根和氢离子均消耗NaOH,而c点只有盐酸消耗NaOH(盐酸完全电离).
解答 解:盐酸溶液中的氢离子主要是盐酸电离出来的,盐酸完全电离,体积和pH都相同的盐酸和氯化铵溶液加水稀释的过程中,盐酸不能继续电离,盐酸溶液中氢离子浓度变化大;水解是微弱的,氯化铵溶液中铵离子可继续水解,溶液中的氢离子浓度变化小,所以含c点的曲线pH变化是盐酸溶液的,含a、b点的曲线pH变化是氯化铵溶液的,
A.稀释前两溶液的pH相同,由于铵根离子的水解程度较小,则氯化铵溶液浓度大于盐酸,稀释相同体积时,氯化铵溶液的浓度大于盐酸,则导电能力:a>c,故A错误;
B.盐酸电离出的氢离子浓度抑制了水的电离,所以c点溶液中水的电离程度最小;水解促进水的电离,由于氯化铵溶液中的氢离子浓度来自于铵根离子水解生成的氢离子,氢离子浓度越大,说明水解程度越大,水的电离程度越大,a点的pH<b点的pH,说明a点酸性大于b点酸性、a点氢离子大于b点氢离子,所以a、b二点溶液水的电离程度a>b,综上所述a、b、c三点溶液水的电离程度a>b>c,故B正确;
C.b点溶液中,根据质子守恒,得出c(OH-)+c(NH3•H2O)=c(H+),故C错误;
D.用等浓度NaOH溶液和等体积b、c处溶液反应,b点为铵根水解导致溶液呈酸性,b点溶液中铵根和氢离子均消耗NaOH,而C点只有盐酸消耗NaOH(盐酸完全电离),故消耗NaOH溶液体积Vb>Vc,故D错误;
故选B.
点评 本题考查弱电解质的电离平衡及其影响,题目难度中等,明确弱电解质溶液稀释时的浓度变化及加水促进弱电解质电离的特点即可解答,试题培养了学生的分析能力及灵活应用能力.


 永乾教育寒假作业快乐假期延边人民出版社系列答案
永乾教育寒假作业快乐假期延边人民出版社系列答案科目:高中化学 来源: 题型:选择题

| A. | 反应①③均属于置换反应 | |
| B. | 反应①中氧化产物和还原产物的质量比为1:2 | |
| C. | 该流程中反应①③的还原剂不能互换使用 | |
| D. | 该流程是实现半导体工业“从沙滩到用户”的基础 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③ | B. | ②④ | C. | ①④ | D. | ②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
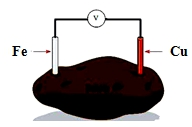
| A. | Fe用作正极 | B. | Cu片质量减少 | ||
| C. | 电子由Fe并经导线流向Cu片 | D. | 实现了电能向化学能的转化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙酸乙酯在碱性条件下的水解反应称为皂化反应 | |
| B. | 乙烷、苯、葡萄糖溶液均不能使酸性高锰酸钾溶液褪色 | |
| C. | 苯的密度比水小,但由苯反应制得的溴苯、硝基苯、环己烷的密度都比水大 | |
| D. | 2,2-二甲基丁烷与2,4-二甲基戊烷的一氯代物种类相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向容量瓶或分液漏斗中注入溶液时,应该将两者口部的玻璃塞倒置在桌面上 | |
| B. | 在实验室做蒸馏实验的装置中用到两个铁架台、三个单孔胶塞 | |
| C. | 将等体积不同浓度的酸性高锰酸钾分别滴入等浓度体积的草酸溶液中,依据褪色快慢,比较浓度对翻译速率的影响 | |
| D. | 过量的浓硫酸与铜屑共热,能得到澄清透明的蓝色溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
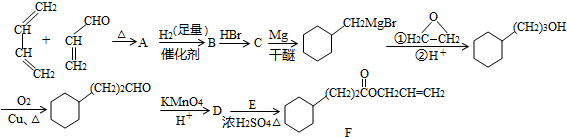
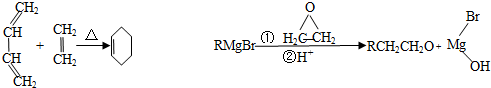
 ,A中所含官能团的名称是醛基、碳碳双键.
,A中所含官能团的名称是醛基、碳碳双键. .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 6Li和7Li的电子数相等,中子数也相等 | |
| B. | 1H和2H是不同的核素,它们的质子数相等 | |
| C. | 14C和14N的质量数相等,它们的中子数不等 | |
| D. | 13C和14C属于同一元素,它们互为同位素 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
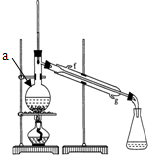 有人设计了一套实验分馏原油的五个步骤:
有人设计了一套实验分馏原油的五个步骤: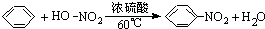 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com