
【题目】在一定条件下,将3 mol A和1 mol B两种气体混合于固定容积为2 L的密闭容器中,发生如下反应:3A(g)+B(g)![]() xC(g)+2D(g)。2 min末该反应达到平衡,生成0.8 mol D,并测得C的浓度为0.2 mol·L-1。下列判断错误的是
xC(g)+2D(g)。2 min末该反应达到平衡,生成0.8 mol D,并测得C的浓度为0.2 mol·L-1。下列判断错误的是
A. x=1
B. B的转化率为80%
C. 2 min内A的平均反应速率为0.3 mol·(L·min)-1
D. 若混合气体的密度不变则表明该反应达到平衡状态
 仁爱英语同步练习册系列答案
仁爱英语同步练习册系列答案 学习实践园地系列答案
学习实践园地系列答案科目:高中化学 来源: 题型:
【题目】将光敏染料(用S表示) 涂在纳米TiO2晶体(可导电) 表面制成其中一个电极,光敏染料可吸收光能将光敏染料S激发成敏化剂S* (高活性光敏材料)后发生下列相关反应:TiO2/S![]() TiO2/S*(激发态);TiO2/S*- e-→TiO2/S+ 2TiO2/S+ +3I-→2TiO2/S+I3-(注: S和S*不是硫单质,是光敏染料的代号)
TiO2/S*(激发态);TiO2/S*- e-→TiO2/S+ 2TiO2/S+ +3I-→2TiO2/S+I3-(注: S和S*不是硫单质,是光敏染料的代号)
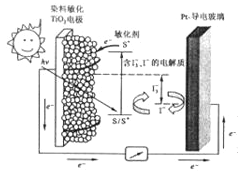
下列关于该太阳能电池叙述错误的是
A. 电池工作时,染料敏化的TiO2 电极为负极
B. 电池工作时,正极发生的反应为I3-+2e-=3I-
C. 电池工作过程中,光敏材料S→S*需要吸收能量,总反应中光敏材料S 不消耗
D. 该电池将光能直接转化为电能
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】同周期的X、Y、Z三种元素,已知最高价氧化物的水化物的酸性由强到弱的顺序为HXO4>H2YO4>H3ZO4,则下列判断错误的是
A. 非金属性: X>Y>Z
B. 气态氢化物的稳定性: HX>H2Y>ZH3
C. 原子半径: X>Y>Z
D. 阴离子的还原性: ![]() > X-
> X-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,AgCl(s)Ag+(aq)+Cl﹣(aq)在水中的沉淀溶解平衡曲线如图所示.下列说法正确的是( ) 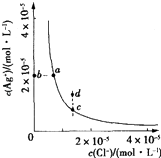
A.加入AgNO3固体,可以使溶液由c点变到d点
B.加入NaCl固体,则AgCl的溶解度减小,Ksp也减小
C.d点有AgCl沉淀生成
D.c点对应的Ksp小于a点对应的Ksp
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
A.不需要加热就能发生的反应是放热反应
B.构成原电池正极和负极的材料必须是两种金属
C.化学能是能量的一种形式,它不仅可以转化为热能,也能转化为电能
D.马口铁(镀锡铁)破损时与电解质溶液接触,锡先被腐蚀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】到目前为止,由化学能转变的热能或电能仍然是人类使用的最主要的能源.
(1)化学反应中放出的热能(焓变,△H)与反应物和生成物的键能(E)有关. 已知:H2(g)+Cl2(g)═2HCl(g)△H=﹣185kJ/mol
E(H﹣H)=436kJ/mol,E(Cl﹣Cl)=243kJ/mol
则E(H﹣Cl)= .
(2)纳米级Cu2O由于具有优良的催化性能而受到关注.已知: 2Cu(s)+ ![]() O2(g)═Cu2O(s)△H=﹣169kJmol﹣1 ,
O2(g)═Cu2O(s)△H=﹣169kJmol﹣1 ,
C(s)+ ![]() O2(g)═CO(g)△H=﹣110.5kJmol﹣1 ,
O2(g)═CO(g)△H=﹣110.5kJmol﹣1 ,
2Cu(s)+O2(g)═2CuO(s)△H=﹣314kJmol﹣1
则工业上用炭粉在高温条件下还原CuO制取Cu2O和CO的热化学方程式为 .
(3)如图是N2和H2反应生成2mol NH3过程中能量变化示意图,请计算每生成1mol NH3放出热量为 . 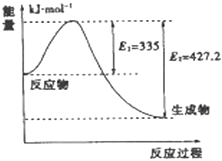
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2Zn(OH)2·ZnCO3是制备活性ZnO的中间体,以锌焙砂(主要成分为ZnO,含少量Cu2+、Mn2+等离子)为原料制备2Zn(OH)2·ZnCO3的工艺流程如下:
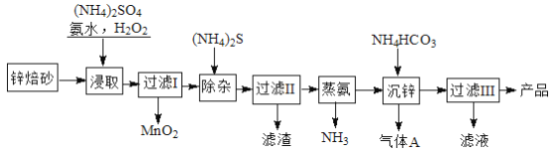
请回答下列问题:
(1)当(NH4)2SO4,NH3·H2O的混合溶液中存在c(NH4+)=2c(SO42-)时,溶液呈___________ (填“酸”、“碱”或“中”)性。
(2)“浸取”时为了提高锌的浸出率,可采取的措施是__________________(任写一种)。
(3)“浸取”时加入的NH3·H2O过量,生成MnO2的离子方程式为____________________________。
(4)“沉锌”的离子方程式为__________________________________。
(5)“过滤III”所得滤液可循环使用,其主要成分的化学式是__________________。
(6)己知:HCN的电离常数Ka=4.9×10 -10, H2S 的电离常数Ka1=1.3×10 -7,Ka2=7.0×10 -15,向NaCN 溶液中通入少量的H2S 气体,反应的离子方程式为______________________________________。在废水处理领域中常用H2S 将Mn2+转化为MnS 除去,向含有0.020 molL-1Mn2+废水中通入一定量的H2S 气体,调节溶液的pH=a,当HS-浓度为1.0×10 -4molL-1时,Mn2+开始沉淀,则a=____________。[已知: Ksp(MnS)=1.4×10 -15]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国知名企业比亚迪公司开发了具有多项专利的锂钒氧化物二次电池,其成本较低,对环境无污染,能量密度远远高于其它材料电池,电池总反应为:V2O5+xLi![]() LixV2O5。下列说法中正确的是
LixV2O5。下列说法中正确的是
A.锂在放电时做正极材料,充电时为阳极材料
B.电池在放电时,Li+向负极移动
C.该电池充电时阳极的反应为:LixV2O5 -xe-=V2O5 + xLi+
D.V2O5只是锂发生反应的载体,不参与电池反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是实验室进行氨气快速制备与性质实验的组合装置,部分固定装置未画出. 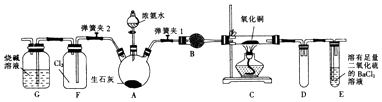
(1)在组装好装置之后,应进行的操作名称是 .
(2)装置B中盛放的试剂是 .
(3)当C中固体全部变为红色后,关闭弹簧夹1,慢慢移开酒精灯,待冷却后,称量C中固体质量,若反应前固体质量为16g,反应后固体质量减少2.4g,则该固体产物的成分是(用化学式表示).从E中逸出液面的气体可以直接排入空气中,请写出在C中发生反应的化学方程式: .
(4)关闭弹簧夹1,打开弹簧夹2,气体进入F中立即产生白烟,同时发现G中溶液迅速倒吸流入F中.请写出产生白烟的化学方程式: , 迅速发生倒吸的原因是 .
(5)为了证明一水合氨是弱碱,甲、乙两同学分别设计如下实验进行探究. ①甲同学用pH试纸测得室温下0.01molL﹣1氨水的pH为10,则认定一水合氨是弱电解质,理由是 .
②乙同学取出10mL 0.1molL﹣1氨水,滴入2滴酚酞试液,溶液显粉红色,再加入少量NH4Cl晶体,观察到 , 证明一水合氨是弱电解质.
③请设计一个与甲、乙同学不同的简单实验方案,证明一水合氨是弱电解质: .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com