
 常温下,向20mL0.2mol•L-1H2C2O4溶液中滴加0.2mol•L-1NaOH溶液.有关微粒物质的量的变化如图(其中I代表H2C2O4,Ⅱ代表HC2O4-,Ⅲ代表C2O42-),根据图示判断,下列说法正确的是( )
常温下,向20mL0.2mol•L-1H2C2O4溶液中滴加0.2mol•L-1NaOH溶液.有关微粒物质的量的变化如图(其中I代表H2C2O4,Ⅱ代表HC2O4-,Ⅲ代表C2O42-),根据图示判断,下列说法正确的是( )| A. | H2C2O4在水中的电离方程式是:H2C2O4?2H++C2O42- | |
| B. | 当V(NaOH)=20mL时,溶液中水的电离程度比纯水小 | |
| C. | 当V(NaOH)=30mL时,溶液中存在以下关系:2c(H+)+2c(HC2O4-)+3c(H2C2O4)═c(C2O42-)+2c(OH-) | |
| D. | 已知H2C2O4的电离常数分别为K1、K2,则a点的c(H+)=K2 |
分析 A、草酸是二元弱酸,分步电离;
B、根据图象知,当V(NaOH)=20时,发生反应为NaOH+H2C2O4═NaHC2O4+H2O,溶液主要为NaHC2O4,HC2O4-以电离为主,溶液显酸性;
C、当V(NaOH)=30mL时,溶液中的溶质为相同物质的量的Na2C2O4和NaHC2O4的混合物,据物料守恒和电荷守恒分析;
D、a点时,c(HC2O4-)=c(H2C2O4).
解答 解:A、草酸是二元弱酸,分步电离,电离方程式为H2C2O4?H++HC2O4-,HC2O4-?H++C2O42-,故A错误;
B、根据图象知,当V(NaOH)=20时,溶液主要为NaHC2O4,HC2O4-以电离为主,溶液显酸性,抑制水的电离,故B正确;
C、当V(NaOH)=30mL时,溶液中的溶质为相同物质的量的Na2C2O4和NaHC2O4的混合物,据物料守恒3c(Na+)=2c(HC2O4-)+2c(H2C2O4)+c(H+)+2c(C2O42-),据电荷守恒c(H+)+c(Na+)=2c(C2O42-)+c(OH-)+c(HC2O4-),所以有4c(H+)+2c(H2C2O4)═4c(C2O42-)+3c(OH-)+c(HC2O4-),故C错误;
D、a点时,c(HC2O4-)=c(H2C2O4),K1=$\frac{c(H{C}_{2}{{O}_{4}}^{-})•c({H}^{+})}{c({H}_{2}{C}_{2}{O}_{4})}$,所以a点的c(H+)=K1,故D错误;
故选B.
点评 本题考查酸碱混合溶液定性判断,侧重于学生的分析能力的考查,为高考常见题型,明确图象中酸碱混合时溶液中的溶质是解答本题的关键,抓住图象进行分析即可,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | ①③ | B. | ②④ | C. | ①② | D. | ②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.

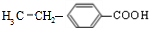 .
. ;反应⑦的化学方程式为
;反应⑦的化学方程式为 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 能用于制作烈性炸药TNT的是甲苯 | |
| B. | 可用于杀菌消毒、制造阿司匹林的是苯酚 | |
| C. | 可用于食品调味剂的是乙酸 | |
| D. | 常用来焊接或切割金属的是苯 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 升温 | B. | 减小反应器的体积 | ||
| C. | 增大 | D. | 降温 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
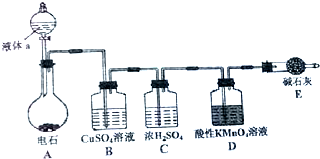 如图是某课外小组制取乙炔并测定乙炔的某些性质的实验.
如图是某课外小组制取乙炔并测定乙炔的某些性质的实验.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com