
分析 (1)混合溶液中溶质的质量分数=$\frac{溶质总质量}{溶液总质量}$×100%;
(2)结合V=$\frac{m}{ρ}$、n=$\frac{m}{M}$、c=$\frac{n}{V}$计算;
(3)结合m=nM及溶液质量分数为20%计算.
解答 解:将20.0g 14.0%的NaCl溶液,跟30.0g 24.0%的NaCl溶液混合,得到密度为1.15g•cm-3的混合溶液,
(1)w(NaCl)=$\frac{20.0g×14.0%+30.0g×24.0%}{20.0g+30.0g}$×100%=$\frac{2.8g+7.2g}{50.0g}$×100%=20.0%,
答:该混合溶液中溶质的质量分数为20%;
(2)V=$\frac{20.0g+30.0g}{1.15g.c{m}^{-3}}$=43.48 cm3,c=$\frac{\frac{10g}{58.5g/mol}}{43.48×1{0}^{-3}L}$=3.93 mol•L-1,
答:该溶液中溶质的物质的量浓度为3.93mol/L;
(3)设1 000 g水中需溶解NaCl的物质的量为x,则$\frac{20.0%}{1-20.0%}$=$\frac{x×58.5g/mol}{1000g}$,解得x=4.27 mol,
答:需溶入4.27摩尔NaCl.
点评 本题考查物质的量浓度的计算,为高频考点,把握物质的量、浓度、质量分数的关系为解答的关键,侧重分析与计算能力的考查,注意基本计算公式的应用,题目难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
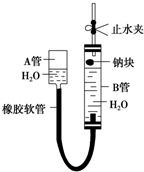 如图是某化学学习小组用来探究钠与水反应的实验装置.该装置可以集反应、收集、检验气体于一体.图中钠块是用大头针叉住的.请填空:
如图是某化学学习小组用来探究钠与水反应的实验装置.该装置可以集反应、收集、检验气体于一体.图中钠块是用大头针叉住的.请填空:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4 L CCl4中含有氯原子数目为4 NA | |
| B. | 7 g C2H4中含有的氢原子数目为NA | |
| C. | 1 mol Al 失去电子变成 Al3+后质子数目为10 NA | |
| D. | 1 L 0.5 mol/L Na2CO3溶液中含有的CO32-数目为0.5 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:4 | B. | 1:5 | C. | 2:1 | D. | 2:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C60与金刚石互为同素异形体 | |
| B. | 114号元素的同位素其中子数为184,则该原子的质量数为298 | |
| C. | 酒精可以和钠发生置换反应,所以酒精属于电解质 | |
| D. | 分子式C2H5Cl只表示一种物质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2 Na2O2+2H2O═4NaOH+O2↑ | B. | 2 Na+2H2O═2NaOH+H2↑ | ||
| C. | 2H2+O2$\frac{\underline{\;点燃\;}}{\;}$ 2H2O | D. | HCl+NH3═NH4Cl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 晶体硅硬度大、熔点高,因而可用于制作半导体材料 | |
| B. | 常温下铝制品可以储运浓硫酸和浓硝酸 | |
| C. | 水煤气、液氯、水玻璃、福尔马林为混合物 | |
| D. | 金属汞一旦洒落在实验室地面或桌面上,必须尽快收集,并深埋处理 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
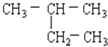

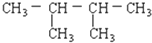
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com