
【题目】CCl3CHO是一种药物合成的中间体,可通过CH3CH2OH+4Cl2→CCl3CHO+5HCl进行制备。制备时可能发生的副反应为C2H5OH+HCl→C2H5Cl+H2O、CCl3CHO+HClO→CCl3COOH+HCl。合成该有机物的实验装置示意图(加热装置未画出)和有关数据如下:
物质 | C2H5OH | CCl3CHO | CCl3COOH | C2H5Cl |
熔点/℃ | -114.1 | -57.5 | 58 | -138.7 |
沸点/℃ | 78.3 | 97.8 | 198 | 12.3 |
溶解性 | 与水互溶 | 可溶于水、乙醇 | 可溶于水、乙醇 | 微溶于水,可溶于乙醇 |
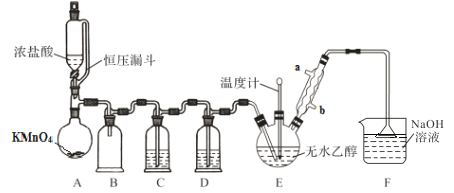
(1)恒压漏斗A的作用是________;A装置中发生反应的化学方程式为________。
(2)装置B的作用是________;装置F在吸收气体时,为什么可以防止液体发生倒吸现象。________。
(3)装置E中的温度计要控制在70 ℃,三口烧瓶采用的最佳加热方式是______。如果要在球形冷凝管中注入冷水增加冷凝效果,冷水应该从________(填“a”或“b”)口通入。实验使用球形冷凝管而不使用直形冷凝管的目的是_______。
(4)实验中装置C中的试剂是饱和食盐水,装置中D的试剂是浓H2SO4。如果不使用D装置,产品中会存在较多的杂质________(填化学式)。除去这些杂质最合适实验方法是_______。
(5)利用碘量法可测定产品的纯度,反应原理如下:
CCl3CHO+NaOH=CHCl3+HCOONa HCOONa+I2=HI+NaI+CO2↑ I2+2Na2S2O3=2NaI+Na2S4O6
称取该实验制备的产品5.00 g,配成100.00 mL溶液,取其中10.00 mL,调节溶液为合适的pH后,加入30.00 mL 0.100 mol·L1的碘标准液,用0.100 mol·L1的Na2S2O3溶液滴定,重复上述3次操作,消耗Na2S2O3溶液平均体积为20.00 mL,则该次实验所得产品纯度为________。
【答案】保持漏斗与反应容器内的气压相等 2KMnO4 +16HCl(浓)=2KCl+2MnCl2+5Cl2↑ + 8H2O 安全瓶(或“防止装置C中液体倒吸入装置A中”) 漏斗口径较大,被吸住的液体会迅速回落烧杯中 水浴 b 增大蒸气与外界接触面积,提高冷凝回流效果 C2H5Cl、CCl3COOH 蒸馏 59%
【解析】
A装置利用高锰酸钾与浓盐酸反应制备氯气,为了防止副反应CCl3CHO+HClO→CCl3COOH+HCl 的发生,需要除去氯气中的水蒸气和氯化氢,因此B装置为安全瓶,C装置用饱和食盐水除去HCl,D装置盛放浓硫酸干燥氯气,E装置中反应制备CCl4CHO,F装置盛放氢氧化钠溶液,吸收尾气中氯气、HCl防止污染空气,据此分析解答。
(1)使用恒压漏斗A可以保持漏斗与反应容器内的气压相等,便于液体流下;A装置中高锰酸钾与浓盐酸反应生成氯气,反应的化学方程式为2KMnO4 +16HCl(浓)=2KCl+2MnCl2+5Cl2↑+ 8H2O,故答案为:保持漏斗与反应容器内的气压相等;2KMnO4 +16HCl(浓)=2KCl+2MnCl2+5Cl2↑+ 8H2O;
(2)装置B为安全瓶,防止装置C中液体倒吸入装置A中;装置F在吸收气体时,由于漏斗口径较大,被吸住的液体会迅速回落烧杯中,因此可以防止液体发生倒吸现象,故答案为:安全瓶(或防止装置C中液体倒吸入装置A中);漏斗口径较大,被吸住的液体会迅速回落烧杯中;
(3)装置E中的温度计要控制在70 ℃,对三口烧瓶加热,最好采用水浴加热。如果要在球形冷凝管中注入冷水增加冷凝效果,冷水应该遵循下进上出的原则,从b口通入。实验使用球形冷凝管可以增大蒸气与外界接触面积,提高冷凝回流效果,因此不使用直形冷凝管,故答案为:水浴;b;增大蒸气与外界接触面积,提高冷凝回流效果;
(4)实验中装置C中的试剂是饱和食盐水,装置中D的试剂是浓H2SO4。如果不使用D装置,生成的氯气中会混入水蒸气,水蒸气与氯气会反应生成次氯酸,从而发生副反应为C2H5OH+HCl→C2H5Cl+H2O、CCl3CHO+HClO→CCl3COOH+HCl,产品中会存在较多的C2H5Cl、CCl3COOH杂质。根据物质的熔沸点和溶解性可知,除去这些杂质最合适的实验方法为蒸馏,故答案为:C2H5Cl、CCl3COOH;蒸馏;
(5) 消耗的Na2S2O3的物质的量=0.100 mol·L1×0.02L=0.002mol,根据I2+2Na2S2O3=2NaI+Na2S4O6可知,溶液中残留的碘的物质的量=0.001mol,因此与样品反应的碘的物质的量=(0.030L ×0.100 mol·L1-0.001mol)×![]() =0.02mol,根据CCl3CHO+NaOH=CHCl3+HCOONa,HCOONa+I2=HI+NaI+CO2↑有CCl3CHO~HCOONa~I2,因此样品中CCl3CHO的物质的量=0.02mol,质量为0.02mol×147.5g/mol=2.95g,实验所得产品纯度=
=0.02mol,根据CCl3CHO+NaOH=CHCl3+HCOONa,HCOONa+I2=HI+NaI+CO2↑有CCl3CHO~HCOONa~I2,因此样品中CCl3CHO的物质的量=0.02mol,质量为0.02mol×147.5g/mol=2.95g,实验所得产品纯度=![]() ×100%=59%,故答案为:59%。
×100%=59%,故答案为:59%。


科目:高中化学 来源: 题型:
【题目】常用调味剂花椒油是一种从花椒籽中提取的水蒸气挥发性香精油,溶于乙醇、乙醚等有机溶剂。利用如图所示装置处理花椒籽粉,经分离提纯得到花椒油。
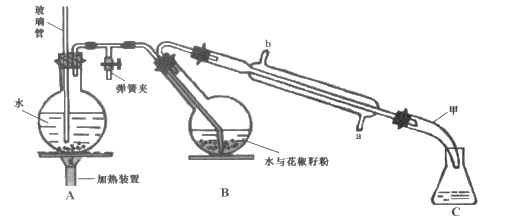
实验步骤:
(一)在A装置中的圆底烧瓶中装入![]() 容积的水,加1~2粒沸石。同时,在B中的圆底烧瓶中加入20g花椒籽粉和50mL水。
容积的水,加1~2粒沸石。同时,在B中的圆底烧瓶中加入20g花椒籽粉和50mL水。
(二)加热A装置中的圆底烧瓶,当有大量蒸气产生时关闭弹簧夹,进行蒸馏。
(三)向馏出液中加入食盐至饱和,再用15mL乙醚萃取2次,将两次萃取的醚层合并,加入少量无水Na2SO4;将液体倾倒入蒸馏烧瓶中,蒸馏得花椒油。
(1)装置A中玻璃管的作用是_______。装置B中圆底烧瓶倾斜的目的是 ________。
(2)步骤(二)中,当观察到_______现象时,可停止蒸馏。蒸馏结束时,下列操作的顺序为_______(填标号)。
①停止加热②打开弹簧夹③关闭冷凝水
(3)在馏出液中加入食盐的作用是__ ;加入无水Na2SO4的作用是_______。
(4)实验结束后,用稀NaOH溶液清洗冷凝管,反应的化学方程式为_________。(残留物以![]() 表示)
表示)
(5)为测定花椒油中油脂的含量,取20.00mL花椒油溶于乙醇中,加80.00mL0.5mol/LNaOH的乙醇溶液,搅拌,充分反应,加水配成200mL溶液。取25.00mL加入酚酞,用0.1moI/L盐酸进行滴定,滴定终点消耗盐酸20.00mL。则该花椒油中含有油脂_______ g/L。
(以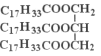 计,式量:884)。
计,式量:884)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于电解质溶液的叙述正确的是( )
A. 室温下,pH=7的NH4Cl与氨水的混合溶液中离子浓度大小顺序为:c(Cl-)>c(NH![]() )>c(H+)=c(OH-)
)>c(H+)=c(OH-)
B. 将pH=4的醋酸溶液稀释后,溶液中所有离子的浓度均降低
C. 中和pH与体积均相同的盐酸和醋酸溶液,消耗NaOH的物质的量相同
D. 室温下,同浓度的Na2S与NaHS溶液相比,Na2S溶液的pH大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数的值。下列叙述正确的是
A. 4.0g由CO2和SO2组成的混合物中含有的质子数为2NA
B. 2.24LCl2与CH4在光照下反应生成的HCl分子数为0.1NA
C. 常温下,0.1mol环氧乙烷(![]() )中含有的共价键数为0.3NA
)中含有的共价键数为0.3NA
D. 4.2gCaH2与水完全反应,转移的电子数为0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用CH4催化还原NOx,可以消除氮氧化物的污染。例如:
①CH4(g)+4NO2(g)===4NO(g)+CO2(g)+2H2O(g) ΔH=-574 kJ·mol-1
②CH4(g)+4NO(g)===2N2(g)+CO2(g)+2H2O(g) ΔH=-1 160 kJ·mol-1
下列说法不正确的是( )
A. 若用标准状况下4.48 L CH4还原NO2生成N2和水蒸气,放出的热量为173.4 kJ
B. 由反应①可推知:CH4(g)+4NO2(g)==4NO(g)+CO2(g)+2H2O(l) ΔH<-574 kJ·mol-1
C. 反应①②转移的电子数相同
D. 反应②中当4.48 L CH4反应完全时转移的电子总数为1.60 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科学家发明了一种“可固氮”的锂-氮二次电池,将可传递Li+的醚类作电解质,电池的总反应为![]()
![]()
![]() 。下列说法正确的是
。下列说法正确的是
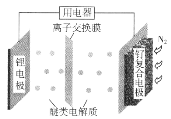
A. 固氮时,锂电极发生还原反应
B. 脱氮时,钌复合电极的电极反应:2Li3N-6e-=6Li++N2↑
C. 固氮时,外电路中电子由钌复合电极流向锂电极
D. 脱氮时,Li+向钌复合电极迁移
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某铅酸蓄电池的工作原理如图所示,其总反应式为Pb+PbO2+2H2SO4=2PbSO4+2H2O。下列判断不正确的是( )
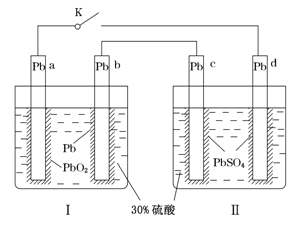
A. 闭合K时,d电极的反应式为PbSO4+2H2O-2e-=PbO2+4H++SO42—
B. 当电路中转移0.2 mol电子时,Ⅰ中消耗的H2SO4为0.2 mol
C. 闭合K时,Ⅱ中SO42—向c电极迁移
D. 闭合K一段时间后,Ⅱ可单独作为原电池,d电极为正极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢气、铝、铁都是重要的还原剂,已知下列反应的热化学方程式,下列关于反应的焓变判断正确的是
2H2(g)+O2(g)===2H2O(g) △H1
3H2(g)+Fe2O3(s)===2Fe (s)+ 3H2O(g) △H2
2Fe(s)+ 3/2O2(g)===Fe2O3(s) △H3
2Al(s)+3/2O2(g)===Al2O3(s) △H4
2Al(s)+ Fe2O3(s)===Al2O3(s)+2Fe(s) △H5
A. △H1<0;△H3>0 B. △H5<0;△H4<△H3
C. △H1=△H2+△H3 D. △H3=△H4+△H5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外活动小组的同学,在实验室做锌与浓硫酸反应的实验时,甲同学认为产生的气体是二氧化硫,而乙同学认为除二氧化硫气体外,还可能产生氢气。为了验证甲、乙两位同学的判断是否正确,丙同学设计了如图所示实验装置(锌与浓硫酸共热时产生的气体为X,且该装置略去),试回答下列问题:

(1)上述反应中生成二氧化硫的化学方程式为__。
(2)乙同学认为还可能产生氢气的理由是__。
(3)丙同学在安装好装置后,必须首先进行的一步操作是__。
(4)A中加入的试剂可能是__,作用是__;B中加入的试剂可能是__,作用是__;E中加入的试剂可能是__,作用是__。
(5)可以证明气体X中含有氢气的实验现象是:
C中:__,
D中:__。
如果去掉装置B,还能否根据D中的现象判断气体X中有氢气?__(填“能”或“不能”),原因是_。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com