
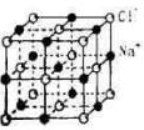
| A、一个金刚石的晶胞中有8个C原子 |
| B、金刚石的密度为3.54g?cm-1 |
| C、在该种CO2晶体中,一个CO2分子由一个C原子和二个氧原子构成 |
| D、在该种CO2晶胞中含氧原子8个 |
| 1 |
| 8 |
| 1 |
| 2 |
| m |
| V |
| 1 |
| 8 |
| 1 |
| 2 |
| ||
| 2 |
| m |
| V |
| ||
| (2.18×10 -10) 3 |


 步步高达标卷系列答案
步步高达标卷系列答案科目:高中化学 来源: 题型:
| A、推广使用燃煤脱硫技术,防治SO2污染 |
| B、实施绿化工程,防治扬尘污染 |
| C、研制开发燃料电池汽车,消除机动车尾气污染 |
| D、加大石油、煤炭的开采速度,增加化石燃料的供应量 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 4 |

查看答案和解析>>
科目:高中化学 来源: 题型:
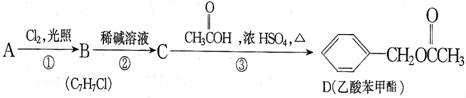
 )是一种重要的有机化合物,其合成路线如下:
)是一种重要的有机化合物,其合成路线如下: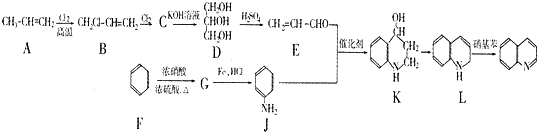
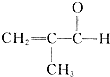 制备物质K的同系物:
制备物质K的同系物:查看答案和解析>>
科目:高中化学 来源: 题型:
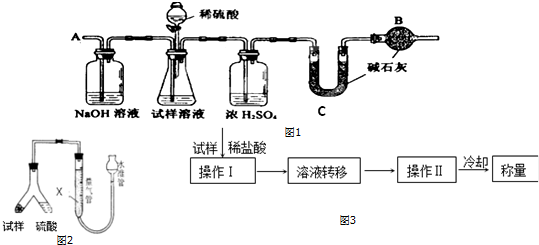
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
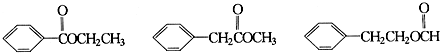
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com