
下列除去杂质的方法正确的是( )
| 物质 | 杂质 | 试剂 | 主要操作 | |
| A | NaHCO3固体 | Na2CO3固体 | / | 加热 |
| B | SiO2 | Fe2O3 | 盐酸 | 过滤 |
| C | KBr溶液 | Br2 | KOH溶液 | 分液 |
| D | Cl2 | HCl | 饱和碳酸钠溶液 | 洗气 |
科目:高中化学 来源: 题型:
(1)在标准状况下,a.6.72 L CH4气体 b.3.01×1023个HCl气体分子 c.13.6g H2S气体 d.0.2mol NH3,下列对这四种气体的关系从大到小的排列是(用上述序号表示)。
①四种气体的物质的量___________________________________;
②标准状况下四种气体的密度_____________________________;
③四种气体的质量_______________________________________。
(2)阿伏加德罗曾做过这样一个实验:一抽空的密闭容器重Mg,在标准状况下,盛满以相同物质的量混合的NO和H2的混合气体后,称量为(M+Q)g。把混合气体排尽,再充满SO2气体,为使天平平衡,应在托盘天平的________边托盘上放置________g砝码。
(3)将10g复盐CuSO4·x(NH4)2SO4·yH2O加到过量的NaOH溶液中加热,生成的氨气用100 mL 0.5mol/L硫酸全部吸收,多余的硫酸用2mol/L NaOH溶液中和,用去NaOH溶液25 mL。已知复盐中SO的质量分数为48%,则x=________,y=________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法不正确的是( )
①用水鉴别苯、乙醇、溴苯; ②用饱和NaCl溶液除去溴苯中杂质Br2
③用酸性高锰酸钾鉴别乙酸、己烯和乙醇;④用点燃的方法鉴别甲烷、乙烯
⑤用溴水可鉴别苯、己烯、乙醇、四氯化碳四种液体
A.①②⑤ B.②③ C.②③⑤ D.①④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
传统的自来水消毒常采用漂白粉等强氧化剂,但其产生的有机氯对人体有一定的危害。一种新型的消毒剂——高铁酸盐(如Na2FeO4或K2FeO4)能有效地杀灭水中的细菌和病毒,同时其产物在水中经过变化后能除去水中的微细悬浮物。在以上变化过程中不可能涉及的变化有( )
A . 电离 B. 水解 C. 置换反应 D. 氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
在给定条件下,下列加点的物质在化学反应中完全消耗的是( )
A.用50mL8mol·L-1浓盐酸与10g二氧化锰共热制取氯气
B.标准状况下,将1g铝片投入20mL18.4mol·L-1的硫酸中
C.向100mL3mol·L-1的稀硝酸中加入5.6g铁
D.在5×107Pa、500℃和铁触媒催化的条件下,用氮气和氢气合成氨
查看答案和解析>>
科目:高中化学 来源: 题型:
Ⅰ (1)用浓硫酸配制250mL2mol∙L-1硫酸溶液时,所需的玻璃仪器除烧杯、玻璃棒和胶头滴管之外,还需要 (填仪器名称);在下列配制过程示意图中,有错误的是(填写序号) 。
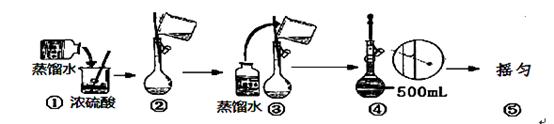
 (2)现要用容量瓶配制500mL0.4mol∙L-1Na2CO3溶液,配好的溶液倒入试
(2)现要用容量瓶配制500mL0.4mol∙L-1Na2CO3溶液,配好的溶液倒入试
剂瓶后需要贴上标签。请你帮助把右图标签上的内容填上去。
(3)下列情况将使配制溶液的物质的量浓度偏低的有 (填序号)
A. 容量瓶用蒸馏水洗净后,未待干燥便用来配制
B. NaOH溶解后趁热移入容量瓶中
C. 定容时,俯视刻度线 D. 摇匀后发现液面未到刻度线,继续加水至刻度线
 Ⅱ 某化学小组模拟“侯氏制碱法”,以NaCl、NH3、CO2和水等为原料以及下
Ⅱ 某化学小组模拟“侯氏制碱法”,以NaCl、NH3、CO2和水等为原料以及下
图所示装置制取NaHCO3,反应的化学方程式为NH3+CO2+H2O+NaCl = NaHCO3↓+NH4Cl。
然后再将NaHCO3制成Na2CO3。
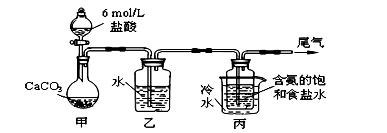
⑴ 装置乙的作用是 。为防止污染空
气,尾气中含有的 需要进行吸收处理。
⑵由装置丙中产生的NaHCO3制取Na2CO3时,需要进行的实验操作有 、
、 。NaHCO3转化为Na2CO3的化学方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是
A. 25℃时NH4Cl溶液的Kw大于100℃时NaCl溶液的Kw
B. SO2通入碘水中,反应的离子方程式为SO2+I2+2H2O SO32―+2I―+4H+
SO32―+2I―+4H+
C. 加入铝粉能产生H2的溶液中,可能存在大量的Na+、Ba2+、AlO2―、NO3-
D. 100℃时,将pH=2的盐酸与pH=12的NaOH溶液等体积混合,溶液显中性
查看答案和解析>>
科目:高中化学 来源: 题型:
草酸是二元中强酸,草酸氢钠溶液显酸性。常温下,向10 mL 0.01 mol/L NaHC2O4溶液中滴加0.01 mol/L NaOH溶液,随着NaOH溶液体积的增加,溶液中离子浓度关系正确的是
A.V(NaOH)= 0时,c(H+)= 1 × 10-2 mol/L
B.V(NaOH)< 10 mL时,不可能存在c(Na+)= 2 c(C2O )+ c(HC2O
)+ c(HC2O )
)
C.V(NaOH)= 10 mL时,c(H+)= 1 × 10-7mol/L
D.V(NaOH)> 10 mL时,c(Na+)> c(C2O )>c(HC2O
)>c(HC2O )
)
查看答案和解析>>
科目:高中化学 来源: 题型:
A、B、C三个烧杯中分别盛有相同物质的量浓度的稀硫酸,如下图所示:

(1)A中反应的离子方程式是 。
(2)B中Sn极的电极反应式为____________________,Sn极附近溶液的酸性__________(填“增强”“减弱”或“不变”)。
(3)C中被腐蚀的金属是__________,总反应离子方程式是____________________,比较A、B、C中铁被腐蚀的速率由快到慢的顺序是__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com