
【题目】设NA为阿伏加德罗常数的值。下列有关叙述正确的是( )
A.23gNa与氧气充分反应,生成Na2O和Na2O2的混合物,转移的电子数为大于NA小于2NA
B.0.5mol甲醇中含有的共价键数为2.5NA
C.标准状况下,0.25molHF的体积为5.6L
D.0.2mol/L的Na2SO4溶液中含Na+ 数为0.4NA
 新思维假期作业寒假吉林大学出版社系列答案
新思维假期作业寒假吉林大学出版社系列答案科目:高中化学 来源: 题型:
【题目】沉积物微生物燃料电池可处理含硫废水,其工作原理如图所示。下列说法错误的是( )

A.碳棒b的电极反应式为:O2+4e-+2H2O=4OH-
B.光照强度对电池的输出功率有影响
C.外电路的电子方向:碳棒a→碳棒b
D.酸性增强不利于菌落存活,故工作一段时间后,电池效率降低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化亚铜(CuCl)常用作催化剂、杀菌剂等。
(1)将Na2SO3溶液逐滴加入到CuCl2溶液中,再加入少量浓盐酸混匀,得到CuCl沉淀。该反应中被氧化的物质是__(填化学式)。
(2)为测定制得CuCl样品的纯度,进行下列实验:
a.称取0.5000g样品,放入盛有20mL过量FeCl3溶液和玻璃珠的锥形瓶中,不断摇动;
b.待样品溶解后,加水50mL;
c.立即用0.2000mol·L-1Ce(SO4)2标准溶液滴至反应完全,记录消耗标准溶液的体积:
d.重复步骤a至c操作2次,记录消耗标准溶液的平均体积为25.00mL.
已知:CuC1+Fe3+=Cu2++Fe2++Cl-、Fe2++Ce4+=Fe3++Ce3+
①配制100mL0.2000mol·L-1的Ce(SO4)2标准溶液时,需要的玻璃仪器除烧杯、量筒、玻璃棒、胶头滴管,还需要___。
②进行步骤c时若操作缓慢,则测得CuCl的纯度___(“偏大”、“偏小”或“无影响")。
③通过计算确定该样品中CuCl的纯度___(写出计算过程)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】纯碱是一种重要的化工原料,广泛应用于玻璃、造纸、纺织和洗涤剂的生产。
(1)起初,人们从盐碱地和盐湖中获得纯碱,但远远不能满足工业发展的需要,纯碱的化学式为________。
1791年,“路布兰制碱法”取得专利。该方法以硫酸、氯化钠、木炭、白垩石(主要成分为碳酸钙)为原料,但在20世纪20年代后被淘汰,因为生产过程中释放出HCl气体,该气体遇空气中的水蒸气易形成酸雾,腐蚀金属设备。
(2)1861年,“索尔维制碱法”问世,该方法是在用氯化钠溶液吸收两种工业废气时意外发现的,反应后生成碳酸氢钠和氯化铵(NH4Cl),再加热碳酸氢钠即可制得纯碱,氯化钠溶液吸收的两种气体为________(填字母)。
A.Cl2 B.NH3 C.SO2 D.CO2
(3)“侯氏制碱法”由我国化学工程专家侯德榜先生于1943年创立,是对“索尔维制碱法”的改进,将氨碱法制取碳酸钠与合成氨联合起来,大大提高了食盐的利用率,缩短了生产流程,减少了对环境的污染,至今仍为全世界广泛采用。
用如图所示装置可以模拟“加热碳酸氢钠制得纯碱”的过程。
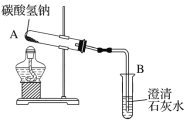
当观察到B中出现浑浊时,停止加热,A中发生反应的化学方程式为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中华传统文化蕴含着很多科学知识,下列说法错误的是
A. “丹砂(HgS烧之成水银,积变又还成丹砂”描述的是可逆反应
B. “水声冰下咽,沙路雪中平”未涉及化学变化
C. “霾尘积聚难见路人”形容的霾尘中有气溶胶,具有丁达尔效应
D. “含浆似注甘露钵,好与文园止消渴”说明柑橘糖浆有甜味,可以止渴
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(14分) 现有25 ℃时0.1 mol/L的氨水。请回答以下问题:
(1)若向氨水中加入少量硫酸铵固体,此时溶液中 c(OH-) / c(NH3·H2O) ______ (填“增大”“减小”或“不变”);
(2)若向氨水中加入稀硫酸,使其恰好中和,写出反应的离子方程式:
_____________________________________________________________________;
所得溶液的pH________7(填“>”“<”或“=”),用离子方程式表示其原因:
_________________ 。
(3)若向氨水中加入稀硫酸至溶液的pH=7,此时c(NH4+)=a mol/L,则c(SO42-)=________;
(4)若向氨水中加入pH=1的硫酸,且氨水与硫酸的体积比为1∶1,则所得溶液中各离子物质的量浓度由大到小的关系是______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生为了探究钠与CO2的反应,利用如图装置进行实验。[已知PdCl2(氯化钯)能被CO还原得到黑色的Pd]

(1)请将上图各装置连接完整(填写装置中序号)②→ 。
(2)若用稀盐酸与CaCO3反应制备CO2,在加稀盐酸时,发现CaCO3与稀盐酸不能接触,而稀盐酸又不够了,为使反应能顺利进行,可向装置②长颈漏斗中加入的试剂是 。
A.CCl4 | B.H2SO4溶液 | C.硝酸钠溶液 | D.植物油 |
(3)检查装置②的气密性,方法是 。
(4)装好药品后,点燃酒精灯之前应进行的操作是打开弹簧夹,让CO2充满整个装置,当观察到 时再点燃酒精灯。
(5)通入CO2的量不同可能会导致生成的产物不同。假如反应过程中有下列两种情况,按要求分别写出两种情况时的化学方程式 。
i.当装置⑤PdCl2溶液中观察到有黑色沉淀产生,装置①中固体成分只有一种,且向固体中加入稀盐酸产生能使澄清石灰水变浑浊的气体,写出此情况时钠与CO2反应的化学方程式 。
ii.当装置①中钠的质量为0.23 g时,充分反应后,将装置①中的固体加入到足量稀盐酸中,产生112 mL的CO2气体(标况下测定),装置⑤PdCl2溶液中没有观察到黑色沉淀产生,写出此情况时钠与CO2反应的化学方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了除去粗盐中的Ca2+、Mg2+、![]() 及泥沙,可将粗盐溶于水,然后进行下列五项操作:①过滤 ②加过量NaOH溶液 ③加适量盐酸 ④加过量Na2CO3溶液 ⑤加过量BaCl2溶液。下列操作顺序中最合适的是
及泥沙,可将粗盐溶于水,然后进行下列五项操作:①过滤 ②加过量NaOH溶液 ③加适量盐酸 ④加过量Na2CO3溶液 ⑤加过量BaCl2溶液。下列操作顺序中最合适的是
A.①④②⑤③B.④①②⑤③C.②⑤④①③D.⑤②④③①
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素周期表短周期中六种元素的原子序数与主要化合价的关系如图:
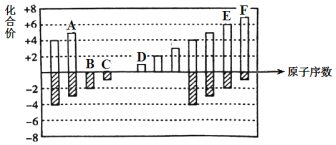
(1)E在元素周期表中的位置是_________。
(2)C、D、F原子半径由大到小的顺序是____________(填元素符号)。
(3)A、B、C的单质与氢气反应剧烈程度由强到弱的顺序____________.(用单质的化学 式表示)。
(4)应用元素周期律和元素周期表的知识,写出D和E形成的化合物的化学式_________、________(写2种)。
(5)判断F的单质和E的最简单氢化物之间能否发生反应,若能则写出反应的化学方程式,若不能则说明理由________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com