
| A. | 金刚石>晶体硅>二氧化硅>碳化硅 | B. | CI4>CBr4>CCl4>CH4 | ||
| C. | MgO>Na2O>N2>O2 | D. | 金刚石>生铁>纯铁>钠 |
分析 A.原子晶体中,熔沸点与键长成反比;
B.分子晶体中熔沸点与其相对分子质量成正比;
C.离子晶体熔沸点大于分子晶体,分子晶体熔沸点与其相对分子质量成正比,离子晶体熔沸点与离子半径成反比,与离子电荷成正比;
D.一般来说,原子晶体熔沸点高于金属晶体,合金熔沸点高于纯金属,金属晶体熔沸点与金属键成正比,金属键与原子半径成反比,与电荷成正比.
解答 解:A.原子晶体中,熔沸点与键长成反比,这几种物质都是原子晶体,键长:C-C<C-Si<Si-Si,所以熔沸点金刚石>二氧化硅>碳化硅>晶体硅,故A错误;
B.组成和结构相似的分子晶体,相对分子质量越大,熔、沸点越大,则熔、沸点为CI4>CBr4>CCl4>CF4,故B正确;
C.离子晶体的熔沸点大于分子晶体,水中含有氢键,熔、沸点比氮气、氧气的大,则熔、沸点为MgO>H20>O2>N2,故C错误;
D.熔、沸点:原子晶体>金属晶体,合金的熔点比纯金属的低,则熔、沸点为金刚石>纯铁>生铁>钠,故D错误;
故选B.
点评 本题考查晶体熔沸点高低判断,明确晶体类型及晶体熔沸点影响因素是解本题关键,注意分子晶体熔沸点与范德华力和氢键有关,易错选项是D,题目难度不大.


科目:高中化学 来源: 题型:解答题
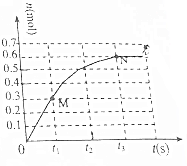 T℃时,向2L密闭恒容容器中充入1mol N2O4(无色气体)发生反应N2O4(g)?2NO2(g).其中NO2的物质的量随时间的变化如图所示.
T℃时,向2L密闭恒容容器中充入1mol N2O4(无色气体)发生反应N2O4(g)?2NO2(g).其中NO2的物质的量随时间的变化如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1 mol Fe与足量盐酸反应,转移的电子数为0.3 NA | |
| B. | 28 g CO中所含的原子数为2 NA | |
| C. | 0.1 mol•L-1Na2CO3溶液中,含有CO32-数为0.1 NA | |
| D. | 标准状况下,22.4 L苯的分子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (1)在两个恒温、恒容的密闭容器中进行下列两个可逆反应:
(1)在两个恒温、恒容的密闭容器中进行下列两个可逆反应:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 当a=b>0时,该反应达到化学平衡状态 | |
| B. | 该反应达到化学平衡状态时,一定有a=b | |
| C. | 当密闭容器内气体密度不再改变时,该反应达到化学平衡状态 | |
| D. | 该反应达到化学平衡状态时,密闭容器内气体的物质的量一定不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 序号 | 条件 | 现象 | 结论 | |
| 温度/℃ | 催化剂 | |||
| 1 | 40 | FeCl3溶液 | ||
| 2 | 20 | FeCl3溶液 | ||
| 3 | 20 | MnO2 | ||
| 4 | 20 | 无 | ||
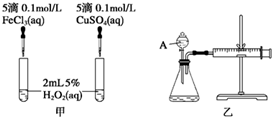
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com