
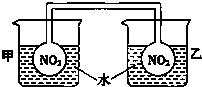
 利用NO2平衡气体遇热颜色加深、遇冷颜色变浅来指示放热过程和吸热过程.
利用NO2平衡气体遇热颜色加深、遇冷颜色变浅来指示放热过程和吸热过程.

科目:高中化学 来源: 题型:
| A、实验中使用的主要仪器是分液漏斗 |
| B、溴在四氯化碳中的溶解度比在水中的溶解度大 |
| C、不可把萃取剂四氯化碳换成酒精 |
| D、分液时,水及溴的四氯化碳溶液均从分液漏斗下口流出 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、室温下,测0.1mol/L HX溶液的pH,若pH>1,证明HX是弱酸 |
| B、室温下,测1mol/L NaX溶液的pH,若pH>7,证明HX是弱酸 |
| C、将等浓度、等体积的HCl和NaX溶液混合,若混合溶液pH<7,证明HX是弱酸 |
| D、相同条件下,对0.1 mol/L的HCl和0.1 mol/L的HX进行导电性实验,若与HX溶液相串联的灯泡较暗,证明HX为弱酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 (1)双氧水能使酸性高锰酸钾溶液褪色,其反应的离子方程式如下,请将相关物质的化学计量数填写在方框里:
(1)双氧水能使酸性高锰酸钾溶液褪色,其反应的离子方程式如下,请将相关物质的化学计量数填写在方框里:| 可能大量含有的阳离子 | H+、Mg2+、Al3+、NH4+、Fe3+ |
| 可能大量含有的阴离子 | Cl-、Br-、CO32-、AlO2- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com