
【题目】在10 ℃时某化学反应速率为0.1 mol·L-1·s-1,若温度每升高10 ℃反应速率增加到原来的2倍,为了把该反应速率提高到1.6 mol·L-1·s-1,则该反应需在什么温度下进行( )
A. 30 ℃B. 40 ℃C. 50 ℃D. 60 ℃
科目:高中化学 来源: 题型:
【题目】N和Si是合成新型非金属材料的两种重要元素.请回答:
(1)基态Si原子的价层电子排布图为;其2p能级的轨道有个伸展方向,电子云的形状为 .
(2)Si原子可形成多种氢化物,其中Si2H4中Si原子的价层电子对数目为 , Si原子的杂化轨道类型为 .
(3)N和Si形成的原子晶体中,N原子的配位数为 .
(4)NaN3常作为汽车安全气囊的填充物,其焰色反应为黄色.大多数金属元素有焰色反应的微观原因为;N3﹣中σ键和π键的数之比为 . B、F与N三种元素同周期,三种基态原子的第一电离能由大到小的顺序为(用元素符号表示).
(5)NaNO2是一种重要的工业原料,NO2﹣的空间构型为 .
(6)SiO2的晶胞与金刚石(如图所示)相似,可以看作Si原子替代C原子后,在两个成键的Si原子间插入1个O原子形成. 
则:①晶胞中最小的环含有个原子.
②若晶体密度为ρgcm﹣3 , 阿伏伽德罗常数为NA , 晶胞中两个最近的Si原子核之间的距离为pm(用代数式表示).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Sn(核电荷数为50)是人类最早使用的元素之一,能形成SnCl2 , SnCl4两种氯化物,SnCl2常温下为白色晶体,具有一维链状的聚合结构,气态时以单分子形式存在,而SnCl4常温下为无色液体.白锡和灰锡是Sn的两种同素异形体,白锡的晶体结构中Sn原子的配位数为4和6,灰锡的晶体结构与金刚石的晶体结构相似.白锡的密度大于灰锡的密度. 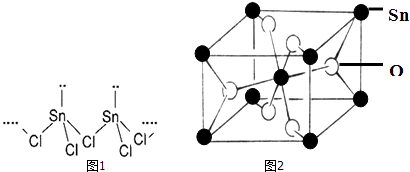
(1)Sn元素外围电子排布式为 .
(2)SnCl2的一维链状聚合结构如图1所示,在分子结构中存在的化学键是 .
(3)SnCl4与CCl4中沸点较高的是 . 原因是 .
(4)锡的某种氧化物的晶胞如图2,其化学式为 .
(5)解释白锡分子的密度大于灰锡的密度的原因 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于硅酸盐材料的说法错误的是
A.普通玻璃的主要成份是SiO2
B.生活中常见的硅酸盐材料有玻璃、水泥、陶瓷
C.陶瓷的主要原料是黏土
D.硅酸盐水泥以石灰石和黏土原料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中,正确的是 ( )
A. 12g碳所含的原子数就是阿伏加德罗常数
B. 阿伏加德罗常数没有单位
C. “物质的量”指物质的质量
D. 摩尔是表示物质的量的单位,每摩尔物质含有阿伏加德罗常数个微粒
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A,B,C三块金属片,进行如下实验,①A,B用导线相连后,同时插入稀H2SO4中,A极为负极;②A,C相连后,同时浸入稀H2SO4 , C极发生氧化反应.则三种金属的活动性顺序为( )
A.A>C>B
B.B>C>A
C.C>A>B
D.A>B>C
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素性质呈周期性变化的决定因素是( )
A. 元素原子半径呈周期性变化B. 元素的相对原子质量依次递增
C. 元素原子核外电子排布呈周期性变化D. 元素的最高正化合价呈周期性变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有机反应只有一种主要生成物(有机物)的是( )
A.CH3CH2CH2Cl在碱性溶液中水解
B.CH2═CH﹣CH═CH2与H2按物质的量之比为1:1进行反应
C.CH3CH═CH2与HCl加成
D.![]() 与NaOH的醇溶液共热
与NaOH的醇溶液共热
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com