
| A. | 溶液pH升高的主要原因:Mg+2H+═Mg2++H2↑ | |
| B. | 生成沉淀a的离子方程式:Ag++Cl-═AgCl↓ | |
| C. | 沉淀b是Mg(OH)2 | |
| D. | 若a、b的物质的量关系为n(a):n(b)=1:3,则可推知固体X的化学式为Mg3(OH)6Cl |
分析 A.据镁条与酸反应,溶液的酸性减弱,pH升高,来分析;
B.据盐酸中氯离子和硝酸银反应来分析;
C.据镁条被盐酸溶解生成镁离子和氢氧根结合生成白色沉淀氢氧化镁来分析;
D.据Ag++Cl-═AgCl↓,Mg2++2OH-═Mg(OH)2↓,进行计算分析.
解答 解:A.据镁条与酸反应即Mg+2H+═Mg2++H2↑,溶液的酸性减弱,pH升高,故A正确;
B.盐酸中氯离子和硝酸银反应,故离子方程式为Ag++Cl-═AgCl↓,故B正确;
C.镁条被盐酸溶解生成镁离子和氢氧根结合生成白色沉淀氢氧化镁,故b是Mg(OH)2,故C正确;
D.设a、b的物质的量分别为1mol,3mol,
Ag++Cl-═AgCl↓
1 1
1 1
则:n(Cl-)=1mol
Mg2++2OH-═Mg(OH)2↓
1 1
3 1
则:n(Mg2+)=3mol,根据电荷守恒得n(OH-)=2n(Mg2+)+n(Cl-)=2×3+1=7mol
故X的化学式为Mg3(OH)7Cl,故D错误;
故选D.
点评 本题考查无机物的推断,为高频考点,把握物质的性质、发生的反应、白色沉淀的判断为解答的关键,侧重分析与推断能力的考查,注意电荷守恒的应用,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A | B | C | D | |
| 用品名称 |  太阳能电池 |  食用油 |  84消毒液 |  合成纤维宇航服 |
| 类别或 主要成分 | SiO2 | 酯类物质 | 混合物 | 高分子材料 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
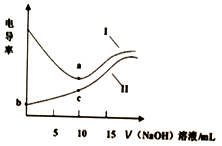 用0.1mol•L-1NaOH溶液分别滴定10mL相同浓度的盐酸和醋酸(溶质用HA表示),利用电导率传感器绘制电导率曲线如图所示.下列说法不正确的是( )
用0.1mol•L-1NaOH溶液分别滴定10mL相同浓度的盐酸和醋酸(溶质用HA表示),利用电导率传感器绘制电导率曲线如图所示.下列说法不正确的是( )| A. | b点pH值大于1 | B. | 盐酸浓度为 0.lmol•L-1 | ||
| C. | c点:c(Na+)>c(A-)>c(H+)>c(OH-) | D. | 曲线Ⅰ为盐酸,曲线Ⅱ为醋酸溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 100 mL 0.2 mol•L-1蔗糖溶液中所含分子总数为0.02NA | |
| B. | 40mL 10mol•L-1的浓盐酸与足量的MnO2充分反应,生成氯气的分子数为0.1NA | |
| C. | 标准状况下,22.4L CHCl3中含有的氯原子数目为3NA | |
| D. | 14g CO 和N2混合气体中含有的电子总数为7NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 为防止中秋月饼等富脂食品氧化变质,常在包装袋中放人生石灰 | |
| B. | 地沟油可以用来制肥皂、提取甘油或者生产生物柴油 | |
| C. | 航天飞船中使用的碳纤维.是一种新型无机非金属材料 | |
| D. | 汽车排放的尾气和冬季取暖排放的顆粒污染物是形成雾霾的一个因素 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
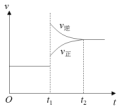 如图是工业合成氨反应的速率-时间图象,在 t1时刻改变某一条件,到 t2时重新达到平衡,判断 t1时刻可能改变条件是( )
如图是工业合成氨反应的速率-时间图象,在 t1时刻改变某一条件,到 t2时重新达到平衡,判断 t1时刻可能改变条件是( )| A. | 使用催化剂 | B. | 升高温度 | C. | 增大压强 | D. | 提高 N2浓度 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com