
【题目】工业上合成氨的原理如下:N2(g)+3H2(g)![]() 2NH3(g) △H。
2NH3(g) △H。
(1)已知H-H键的键能为436 kJmol-1,N-H键的键能为391kJmol-1,N=N键的键能是945.6 kJmol-1,则上述反应的△H=________。
(2)若上述反应在甲、乙、丙、丁四个同样的密闭容器中进行,在同一段时间内测得容器内的反应速率分别为甲:v(NH3)=3.5 molL-1 min-1;乙:v(N2)=2 molL-1 min-1; 丙:v(H2)=4.5molL-1 min-1;丁:v(NH3)=0.075 molL-1 min-1。若其他条件 相同,温度不同,则温度由高到低的顺序是______________(填序号)。
(3)在一定温度下,将1 molN2和3 mol H2混合置于体积不变的密闭容器中发生反应,达到平衡状态时,测得气体总物质的量为 2.8 mol,容器压强为8 MPa。则平衡常数Kp =________(用平衡分压代替浓度计算,分压=总压×物质的量分数)。
(4)在773 K时,分別将2 molN2和6 mol H2充入一个固定容积为1 L的密闭容器中,随着反应的进行,气体混合物中各物质的浓度与反应时间t的关系如图所示。

①图中表示c(N2)-t的曲线是________。
②该温度下,若向同容积的另一容器中投入的N2、H2、NH3的浓度均为3 mol·L-l,则此时v正________v逆(填“>”“<”或“=”)。
【答案】 -92. 4kJ mol-1 丁>乙>甲>丙 ![]() (或 0.26K) 乙 >
(或 0.26K) 乙 >
【解析】(1)反应热△H=反应物的总键能-生成物的总键能,故945.6 kJmol-1+3×436 kJmol-1-2×3×391kJmol-1= -92. 4kJ mol-1;(2)将速率全换成用N2表示:甲:v(N2)=v(NH3)/2=1.75molL-1 min-1;乙:v(N2)=2 molL-1 min-1; 丙:v(N2)=v(H2)/3=1.5molL-1 min-1;丁:v(N2)=v(NH3)/2=0.0375 molL-1 min-1。故反应速率顺序为:丁>乙>甲>丙;
(3)设参加反应的氮气物质的量为xmol,
该反应中N2(g)+3H2(g)![]() 2NH3(g)
2NH3(g)
起始(mol)1 3 0
变化(mol) x 3x 2x
平衡(mol) 1-x 3-3x 2x
列式可得:(1-x)+(3-3x)+2x=2.8,x=0.6;
平衡时各物质的压强之比等于其物质的量之比,所以P(N2)= ![]() ;P(H2)=
;P(H2)= ![]() ,P(NH3)=
,P(NH3)= ![]() ,化学平衡常数Kp=
,化学平衡常数Kp=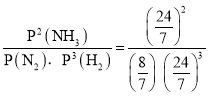 =0.26;
=0.26;
(4)①由反应方程式可知:N2(g)+3H2(g)![]() 2NH3(g)变化量之比等于对应物质的化学计量数之比,而△n甲:△n乙:△n丙=3:1:2,所以表示c(N2)~t的曲线是乙;②由表可知表可知25min反应达平衡状态,
2NH3(g)变化量之比等于对应物质的化学计量数之比,而△n甲:△n乙:△n丙=3:1:2,所以表示c(N2)~t的曲线是乙;②由表可知表可知25min反应达平衡状态,
N2(g)+3H2(g)![]() 2NH3(g),
2NH3(g),
初起(mol·L-1):2 6 0
变化(mol·L-1):1 3 2
平衡(mol·L-1):1 3 2
此时平衡常数为:K=![]() ,根据Qc=
,根据Qc=![]() <K,所以平衡正向移动,即此时v正大于v逆。
<K,所以平衡正向移动,即此时v正大于v逆。


科目:高中化学 来源: 题型:
【题目】下列叙述中正确的是( )
A. 聚乙烯、植物油都是混合物,都能使溴的四氯化碳溶液褪色
B. 苯、溴水、铁粉混合制成溴苯
C. 沸点:戊烷>丁烷>乙烷
D. 烷烃可以使酸性高锰酸钾溶液褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列做法能改善空气质量的是
A. 以煤等燃料作为主要生活燃料 B. 鼓励私人购买和使用汽车代替公交车
C. 限制使用电动车 D. 利用太阳能、风能和氢能等能源替代化石能源
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁和铁合金是生活中常用的材料,下列说法正确的是
A. 一定条件下,铁粉可与水蒸气反应 B. 不锈钢是铁合金,只含金属元素
C. 铁与盐酸反应,铁合金不与盐酸反应 D. 在空气中,铁板比镀锌铁板更耐腐蚀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,几种酸的电离平衡常数如下:
化学式 | HCOOH | H2CO3 | HClO |
电离平衡常数 | 1.7×10-4 | K1=4.3×10-7 K2=5.6×10-11 | 3.0×10-8 |
(1)上述三种弱酸中,酸性最强的是______________________________(填化学式),其电离方程式为_____________________________________________,电离平衡常数表达式K=_________。
(2)写出H2CO3溶液中存在的各种离子的符号:_________________________________。
(3)向Na2CO3溶液中加入足量HClO,有关反应的离子方程式为____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车尾气净化中的一个反应如下:2NO(g)+2CO(g)![]() N2(g)+2CO2(g)△H=-373.4kJ/mol-1,若反应在恒容的密闭容器中达到平衡状态,下列有关说法正确的是( )
N2(g)+2CO2(g)△H=-373.4kJ/mol-1,若反应在恒容的密闭容器中达到平衡状态,下列有关说法正确的是( )
A. 其它条件不变,加入催化剂,△H变大
B. 充入氦气使体系压强增大,可提高反应物的转化率
C. 及时除去二氧化碳,能使NO完全转化
D. 若升高温度,该反应的平衡常数增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将15.66g镁铝合金加入到800mL稀硝酸中,恰好完全反应(假设反应中还原产物只有NO),向所得溶液中加入足量的3mol·L-1NaOH溶液,测得生成沉淀的质量与原合金的质量相等,则下列有关叙述不正确的是
A. 原稀硝酸的浓度为2.6mol·L-1 B. 生成NO的体积为11.648L(标准状况)
C. 反应过程中共消耗1.56molNaOH D. 合金中Al的质量分数约为58.6%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,将10mL 质量分数为50%(密度为1.4g/cm3)的硫酸稀释成100mL。下列说法正确的是
A. 俯视容量瓶颈刻度线定容,所配溶液的浓度偏低
B. 上述稀释过程所需要的蒸馏水为90mL
C. 50%的硫酸溶液中溶质的物质的量浓度为7.14mol/L
D. 上述100mL稀硫酸中含溶质14g,该稀硫酸不属于电解质
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com