
分析 由信息可知:2X(g)?Y(g)+3Z(g)
开始 3mol 0 0
转化 2x x 3x
平衡 3-2x x 3x
反应达到平衡,此时测得容器内的压强为起始时的1.2倍,则$\frac{3-2x+x+3x}{3}$=1.2,解得x=0.3,
(1)Y的物质的量增加0.2mol,结合v=$\frac{△c}{△t}$计算;
(2)依据化学反应速率之比等于化学方程式中计量数之比,把四种情况下的反应速率化为一种物质表示的反应速率减小比较,温度越高反应速率越大;
(3)体积不变平衡体系中充入氩气,平衡体系中各物质的浓度不变;向达到(1)的平衡体系中移走部分混合气体,气体的物质的量减小,相当于减小压强;
(4)若在相同条件下向I的平衡体系中再充入0.5mol X气体,相当于增大压强,平衡逆向进行,X的转化率减小.
解答 解:由信息可知:2X(g)?Y(g)+3Z(g)
开始 3mol 0 0
转化 2x x 3x
平衡3-2x x 3x
反应达到平衡,此时测得容器内的压强为起始时的1.2倍,则$\frac{3-2x+x+3x}{3}$=1.2,解得x=0.3,
(1)Y的物质的量增加0.3mol,由v=$\frac{△c}{△t}$=$\frac{\frac{0.3mol}{2L}}{5min}$=0.03mol/(L.min),故答案为:0.03;
(2)将四个反应速率甲:ν(X)=3.5mol(L•min);乙:ν(Y)=2mol(L•min);丙:ν(Z)=4.5mol(L•min);丁:ν(X)=0.075mol(L•s),都统一到用X表示的反应速率值分别为甲:ν(X)=3.5mol(L•min);乙:ν(X)=4mol(L•min);丙:ν(X)=3mol(L•min);丁:ν(X)=4.5mol(L•min),所以化学反应速率是丁>乙>甲>丙,温度越高,化学反应速率越快,所以温度大小关系是:丁>乙>甲>丙,
故答案为:丁>乙>甲>丙;
(3)体积不变平衡体系中充入氩气,平衡体系中各物质的浓度不变,则平衡不移动;向达到(1)的平衡体系中移走部分混合气体,气体的物质的量减小,相当于减小压强,该反应为气体体积增大的反应,则平衡向右移动,
故答案为:不移动;右;
(4)若在相同条件下向达到(1)所述的平衡体系中再充入0.5molX气体,反应体系内的压强增大,平衡向着逆向移动,X的转化率降低,
故答案为:D.
点评 本题考查化学平衡的计算及平衡移动,把握达到平衡后压强与物质的量的变化为解答的关键,侧重分析能力、计算能力的考查,注意平衡计算的格式,题目难度中等.


 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案科目:高中化学 来源: 题型:解答题
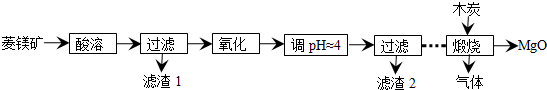
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 使用合适的催化剂可大大提高生产效率 | |
| B. | 由反应需在300℃进行,可知该反应是吸热反应 | |
| C. | 增大原料气中CO2的百分含量,可以提高H2的转化率 | |
| D. | 70MPa的压力,不仅可以增加单位时间内的产出,还可以提高CO2和H2的利用率 |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江西省高二上第一次月考化学卷(解析版) 题型:填空题
如图所示,当关闭K时,向A 中充入2molX、7molY,向B中充入4molX、14molY,起始时体积V(A)=V(B)=a L,在相同温度和有催化剂存在的条件下,两容器各自发生下列反应:2X(g)+2Y(g)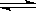 Z(g)+2W(g)△H<0达到平衡(Ⅰ)时V(B)=0.9a L,试回答:
Z(g)+2W(g)△H<0达到平衡(Ⅰ)时V(B)=0.9a L,试回答:
(1)B中X的转化率α(X)B为_________。
(2)A中W和B中Z的物质的量的比较:n(W)A __________________ n(Z)B(填<、>、或=)
(3)打开K,过一段时间重新达平衡(Ⅱ)时,B的体积为_________升(用含a的代数式表示,连通管中气体体积不计)
(4)要使B容 器恢复原来反应前的体积,可采取的措施是____________________。
器恢复原来反应前的体积,可采取的措施是____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
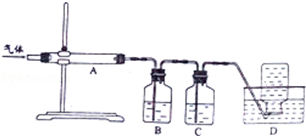
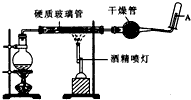 在常温下,Fe与水并不起反应,但在高温下,Fe与水蒸气可发生反应. 应用下列装置,在硬质玻璃管中放入还原铁粉和石棉绒的混合物,加热,并通入水蒸气,就可以完成高温下“Fe与水蒸气的反应实验”. 请回答该实验中的问题.
在常温下,Fe与水并不起反应,但在高温下,Fe与水蒸气可发生反应. 应用下列装置,在硬质玻璃管中放入还原铁粉和石棉绒的混合物,加热,并通入水蒸气,就可以完成高温下“Fe与水蒸气的反应实验”. 请回答该实验中的问题.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| A | |||||||
| B | C | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A | B | C | D | |
| 强电解质 | NaCl | H2SO4 | HClO | HNO3 |
| 弱电解质 | HF | BaSO4 | CaCO3 | CH3COOH |
| 非电解质 | Cl2 | CS2 | C2H5OH | SO2 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com