
【题目】下列反应中水只表现还原性的是
A. 3NO2+H2O=2HNO3+NO
B. 2H2O ![]() 2H2↑+O2↑
2H2↑+O2↑
C. 2F2+2H2O=4HF+O2
D. 2Na+2H2O=2NaOH+H2↑
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】相同温度下,在体积相等的三个恒容器闭容器中发生可逆反应:2NH3(g)![]() N2(g)+3H3(g) ΔH=+92.4 kJ/mol。
N2(g)+3H3(g) ΔH=+92.4 kJ/mol。
实验测得起始、平衡时的有关数据如下表:
容器 编号 | 起始时各物质物质的量/mol | 平衡时反应中 的能量变化 | ||
NH3 | N2 | H2 | ||
① | 2 | 0 | 0 | 吸收热量a kJ |
② | 0 | 1 | 3 | 放出热量b kJ |
③ | 4 | 0 | 0 | 吸收热量c kJ |
下列叙述正确的是( )
A.热量关系:a=b
B.①②③反应的平衡常数:③>①>②
C.达平衡时H2的体积分数:①>③
D.①中的密度不再改变时说明反应已达到平衡状态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以炼锌厂的烟道灰(主要成分为ZnO,另含少量Fe2O3、CuO、SiO2、MnO等)为原料可生产草酸锌晶体(ZnC2O42H2O). 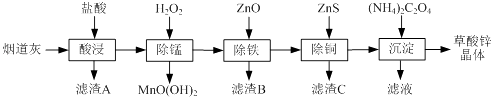
有关氢氧化物开始沉淀和沉淀完全的pH如下表:
氢氧化物 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 | Zn(OH)2 |
开始沉淀的pH | 1.5 | 6.5 | 4.2 | 5.4 |
沉淀完全的pH | 3.3 | 9.7 | 6.7 | 8.2 |
请问答下列问题:
(1)滤渣A的主要成分为 .
(2)除锰过程中产生MnO(OH)2沉淀的离子方程式为 .
(3)①除铁(部分Cu2+可能被除去)时加入ZnO控制反应液pH的范围为 . ②上述流程中除铁与除铜的顺序不能颠倒,否则除铁率会减小,其原因是 .
(4)若沉淀过程采用Na2C2O4代替(NH4)2C2O4生产草酸锌晶体,合理的加料方式是 .
(5)将草酸锌晶体加热分解可得到一种纳米材料.加热过程中固体残留率随温度的变化如下图所示,300℃~460℃范围内,发生反应的化学方程式为 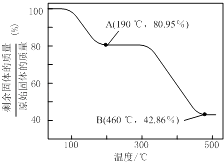
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】明星药物青蒿素的分子式为C15H22O5 , 键线式为 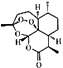 .关于它的说法中,正确的是( )
.关于它的说法中,正确的是( )
A.青蒿素是一种氧化物
B.青蒿素中氧元素的质量分数为11.9%
C.青蒿素中C,H,O三种元素的质量比为90:11:40
D.青蒿素是由15个碳原子、22个氢原子和5个氧原子构成的
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质:①氢氟酸;②浓H2SO4;③烧碱溶液;④Na2CO3固体;⑤氧化钙;⑥ 浓HNO3,其中在常温下能与SiO2反应的有 ( )
A. ①②⑥ B. ①③ C. ①③⑤ D. ②③⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F是前四周期原子序数依次增大的六种元素.A元素原子的核外电子数等于其电子层数,B元素基态原子有三个能级且各能级电子数相同,A与D可形成两种常见液态化合物G、H,其原子数之比分别为1:1和2:1,E元素原子的K、L层电子数之和等于其M、N层电子数之和,F被称为继铁、铝之后的第三金属,可用于制造飞机、火箭、人造卫星、宇宙飞船等领域.请回答下列各题(涉及元素请用相应化学符号表示):
(1)B,C,D中第一电离最大的元素其基态原子有种不同能量的电子.
(2)G分子中D原子的杂化方式为 , F2+的基态价电子排布式为 .
(3)BA3﹣离子的空间构型为 , 与其互为等电子体的一种阳离子的电子式为 .
(4)某化合物晶胞结构如图所示,E2+的配位数是 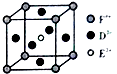
(5)用高能射线照射液态H时,一个H分子能释放出一个电子,同时产生一种阳离子.
①释放出来的电子可以被若干H分子形成的“网”捕获,你认为H分子间能形成“网”的原因是
②由H分子释放出电子时产生的一种阳离子具有较强的氧化性,试写出该阳离子与SO2水溶液反应的离子方程式;该阳离子还能与H分子作用生成羟基,经测定此时的H具有酸性,写出该过程的离子方程式 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质间的反应中,不属于离子反应的是( )
A. Zn和H2SO4(稀)反应
B. NaCl溶液和AgNO3溶液反应
C. C和O2反应
D. Fe和CuSO4溶液反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com