
�����Ϊ2 L�ĺ����ܱ������з�����ӦxA(g)+yB(g) zC(g)��ͼI��ʾ200��ʱ������A��B��C���ʵ�����ʱ��ı仯��ͼ���ʾ��ͬ�¶���ƽ��ʱC�������������ʼn(A):n(B)�ı仯��ϵ�������н�����ȷ����
zC(g)��ͼI��ʾ200��ʱ������A��B��C���ʵ�����ʱ��ı仯��ͼ���ʾ��ͬ�¶���ƽ��ʱC�������������ʼn(A):n(B)�ı仯��ϵ�������н�����ȷ����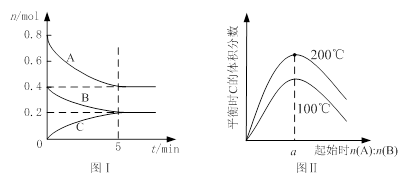
A��200��ʱ����Ӧ�ӿ�ʼ��ƽ���ƽ������v(B)=" 0." 02 mol��L��1��min��1
B��ͼ����֪��ӦxA(g)+yB(g) zC(g)�ġ�H<0����a=2
zC(g)�ġ�H<0����a=2
C������ͼ����ʾ��ƽ��״̬�£�������ϵ�г���He�����´ﵽƽ��ǰv(��)>v(��)
D��200��ʱ���������г���2 mol A ��1 mol B���ﵽƽ��ʱ��A �������������0.5
A
�������������A��ͼI��B��0.4���ٵ�0.2Ħ����v(B)=0.2/(2��5)=" 0." 02 mol��L��1��min��1����ȷ��B����ͼI��֪x��y��z��Ϊ2��1��1��ͼ����֪��ӦxA(g)+yB(g) zC(g)�������¶ȣ�ƽ��ʱC�������������ƽ�������ƶ�����H>0��a=2������C������ͼ����ʾ��ƽ��״̬�£�������ϵ�г���He�������Ũ�Ȳ��䣬ƽ�ⲻ�ƶ�������D��ͼI��A �����������0.5��n(A):n(B)=2:1������ʼʱ����2molA��1molB��Ũ�ȼӱ���Ч������ѹǿ��ƽ�������ƶ���A���������С��0.5������
zC(g)�������¶ȣ�ƽ��ʱC�������������ƽ�������ƶ�����H>0��a=2������C������ͼ����ʾ��ƽ��״̬�£�������ϵ�г���He�������Ũ�Ȳ��䣬ƽ�ⲻ�ƶ�������D��ͼI��A �����������0.5��n(A):n(B)=2:1������ʼʱ����2molA��1molB��Ũ�ȼӱ���Ч������ѹǿ��ƽ�������ƶ���A���������С��0.5������
���㣺���黯ѧ��Ӧ���� ��ɳ����ԭ�� ��Чƽ��


 ͬ����ϰ���ϴ�ѧ������ϵ�д�
ͬ����ϰ���ϴ�ѧ������ϵ�д� ͬ����ϰ����ʦ����ѧ������ϵ�д�
ͬ����ϰ����ʦ����ѧ������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
���й��ڻ�ѧ��Ӧ���ʵ�˵����ȷ����( )
| A�����ݻ�ѧ��Ӧ���ʵĴ�С����֪����ѧ��Ӧ���еĿ��� |
| B����ѧ��Ӧ����Ϊ0.8mol/(L��s)��ָ1sʱij���ʵ�Ũ��Ϊ0.8mol/L |
| C����ѧ��Ӧ������ָһ��ʱ���ڷ�Ӧ������ʵ������ٻ�����������ʵ������� |
| D�������κλ�ѧ��Ӧ��˵����Ӧ����Խ��Ӧ�����Խ���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
���и�������ʾ��ͼһ�µ���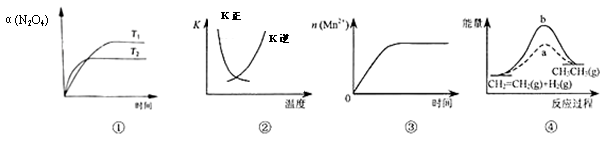
A��ͼ�ٱ�ʾN2O4(g) 2NO2(g) ��H��0��N2O4ת�������¶ȡ�ʱ��ı仯 2NO2(g) ��H��0��N2O4ת�������¶ȡ�ʱ��ı仯 |
B��ͼ�������߱�ʾ��Ӧ2SO2(g)+O2(g) 2SO3(g) ��H��0�������淴Ӧ��ƽ�ⳣ��K���¶ȵı仯 2SO3(g) ��H��0�������淴Ӧ��ƽ�ⳣ��K���¶ȵı仯 |
| C��ͼ�۱�ʾ10 mL0.01 mol/LKMnO4������Һ�����0.1mol/LH2C2O4��Һ���ʱ��n(Mn2+)��ʱ��ı仯 |
| D��ͼ����a��b���߷ֱ��ʾ��ӦCH2��CH2(g)+H2(g) |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
���¶ȡ��ݻ���ͬ�������ܱ������з�����ӦN2(g) + 3H2(g) 2NH3(g) ��H= ��92.4kJ/mol������ͬ��ʽͶ�뷴Ӧ����ֺ��¡����ݣ���÷�Ӧ�ﵽƽ��ʱ���й��������£�
2NH3(g) ��H= ��92.4kJ/mol������ͬ��ʽͶ�뷴Ӧ����ֺ��¡����ݣ���÷�Ӧ�ﵽƽ��ʱ���й��������£�
| ���� | �� | �� | �� |
| ��Ӧ��Ͷ���� | 1molN2��3molH2 | 2molNH3 | 4molNH3 |
| NH3��Ũ��(mol/L) | c1 | c2 | c3 |
| ��Ӧ�������仯 | �ų�a kJ | ����b kJ | ����c kJ |
| ��ϵѹǿ | P1 | P2 | P3 |
| ��Ӧ��ת���� | ��1 | ��2 | ��3 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
��һ�������£������ܱ������н��еĿ��淴Ӧ��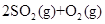
 2SO3��g��������˵������ȷ����
2SO3��g��������˵������ȷ����
| A���ı䷴Ӧ�������Ըı�÷�Ӧ���� |
| B���ﵽƽ���SO3��SO2��O2���ܱ������й��� |
| C���ﵽƽ���Ӧֹͣ�������淴Ӧ���ʶ������� |
| D��SO3��SO2��O2��Ũ�ȱ��ֲ��䣬˵���ÿ��淴Ӧ�ﵽ��ƽ��״̬ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
ʵ������п����VmLŨ��Ϊ10%��ϡ���ᷴӦ��ȡ����������Ӧ������м����������ʣ����ڷ�Ӧ����v˵����ȷ����
| A������Na2SO4���壬v(H2)��С | B��VmLBaCl2��Һ��v(H2)���� |
| C������ϸС��̼����v(H2)���� | D������NH4HSO4���壬v(H2)���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
һ�������£�Cu2+��Mn2+��Fe3+��Ũ�ȶ������ڹ����´��������ʵ�Ӱ����ͼ��ʾ�������жϴ������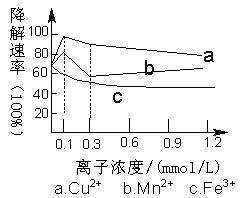
| A����ʵ�鷽����ȱ��֮һ��δ���հ���ʵ�� |
| B��Cu2+��Mn2+������ή�����ʵ����Ũ��Ϊ0.1 mmol��L��l |
| C��Fe3+���������������� |
| D����ͬ�����£�������Cu2+��Mn2+��Fe3+�����µĽ����������μ�С |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
���淴ӦaA(g)+bB(g) cC(g)+dD(s)����H��QkJ��mol-1����Ӧ�����У���������������ʱ��ij�����ڻ�����еĺ������¶ȣ�T������Ӧ���ʣ�v����ѹǿ�Ĺ�ϵ��ͼ��ʾ����ͼ����������˵����ȷ����
cC(g)+dD(s)����H��QkJ��mol-1����Ӧ�����У���������������ʱ��ij�����ڻ�����еĺ������¶ȣ�T������Ӧ���ʣ�v����ѹǿ�Ĺ�ϵ��ͼ��ʾ����ͼ����������˵����ȷ����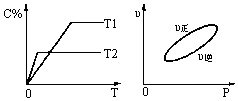
| A��T1��T2��Q��0 |
| B������ѹǿ��B��ת���ʼ�С |
| C������Ӧ��ƽ��ʱ�����������ܶȲ��ٱ仯 |
| D��a+b��c+d |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
һ�������£������Ϊ10 L���ܱ������У�1 mol A��1 mol B���з�Ӧ��2A(g)��B(g) 2C(g)����60 s�ﵽƽ�⣬����0.6 mol C������˵����ȷ����
2C(g)����60 s�ﵽƽ�⣬����0.6 mol C������˵����ȷ����
A����AŨ�ȱ仯��ʾ�ķ�Ӧ����Ϊ0.001 mol��L��1��s��1
B�������������䣬�����������Ϊ5 L��C��ƽ��Ũ�ȱ�Ϊԭ����2��
C�������������䣬������ѹǿ��������A��ת���ʼ�С
D���ﵽƽ��ʱ��C������ٷֺ���Ϊ0.353
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com