
【题目】(1)已知3N2H4(l)![]() 4NH3(g)+N2(g) △H = —336.6kJ/mol,
4NH3(g)+N2(g) △H = —336.6kJ/mol,
N2(g)+3H2(g)![]() 2NH3(g) △H = —92.4kJ/mol,
2NH3(g) △H = —92.4kJ/mol,
则N2H4(g)![]() N2(g)+2H2(g) △H = ________________。
N2(g)+2H2(g) △H = ________________。
(2)写出下列物质的电离方程式:
①NaHSO4___________________________________,
②K2SO4_____________,
③NH4NO3___________________________。
(3)写出下列物质的电子式:
Na2S:_________;CO2:_________。
【答案】-50.6 kJ /mol NaHSO4 =Na+ +H++SO42- K2SO4 =2K++SO42- NH4NO3=NH4 + + NO3- ![]()
![]()
【解析】
(1)根据盖斯定律进行相加减,即可计算出△H
(2)①NaHSO4在水溶液中完全电离,生成 Na+ 和H+和SO42-;
②K2SO4属于强电解质,完全电离生成K+和SO42;
③NH4NO3属于强电解质,完全电离生成NH4 + 和NO3-;
(3)Na2S电子式为![]() ;CO2电子式为
;CO2电子式为![]() ;
;
(1)将3N2H4(l)![]() 4NH3(g)+N2(g) △H = —336.6kJ/mol,N2(g)+3H2(g)
4NH3(g)+N2(g) △H = —336.6kJ/mol,N2(g)+3H2(g)![]() 2NH3(g) △H = —92.4kJ/mol,分别标为①和②,①-2×②得,3N2H4(g)
2NH3(g) △H = —92.4kJ/mol,分别标为①和②,①-2×②得,3N2H4(g)![]() 3N2(g)+6H2(g) △H = -151.8kJ/mol,故N2H4(g)
3N2(g)+6H2(g) △H = -151.8kJ/mol,故N2H4(g)![]() N2(g)+2H2(g) △H = -50.6 kJ /mol;
N2(g)+2H2(g) △H = -50.6 kJ /mol;
(2)①NaHSO4在水溶液中完全电离,生成 Na+ 和H+和SO42-,故NaHSO4 =Na+ +H++SO42- ②K2SO4属于强电解质,完全电离生成K+和SO42-,故K2SO4 =2K++SO42- ;
③NH4NO3属于强电解质,完全电离生成NH4 + 和 NO3-,故NH4NO3=NH4 + + NO3-
(3)Na2S中含有2个Na+和1个S2-,其电子式为![]() ;CO2中C原子和O原子共用了两对电子,其电子式为
;CO2中C原子和O原子共用了两对电子,其电子式为![]() ;
;


 芝麻开花课程新体验系列答案
芝麻开花课程新体验系列答案科目:高中化学 来源: 题型:
【题目】有四种不同堆积方式的金属晶体的晶胞如图所示,下列有关说法正确的是( )

A. ①为简单立方堆积,②为镁型,③为钾型,④为铜型
B. 每个晶胞含有的原子数分别为:①1个,②2个,③2个,④4个
C. 晶胞中原子的配位数分别为:①6,②8,③8,④12
D. 空间利用率的大小关系为:①<②<③<④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学一物质结构与性质]
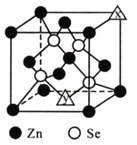
硒化锌是一种半导体材料,回答下列问题。
(1)锌在周期表中的位置_____________;Se基态原子价电子排布图为___________。元素锌、硫和硒第一电离能较大的是______________________(填元素符号)。
(2)Na2SeO3分子中Se原子的杂化类型为___________;H2SeO4的酸性比H2SeO3强,原因是_________________________________________________。
(3)气态SeO3分子的立体构型为__________;下列与SeO3互为等电子体的有____(填序号)。
A.CO32- B.NO3- C.NCl3 D.SO32-
(4)硒化锌的晶胞结构如图所示,图中X和Y点所堆积的原子均为_____(填元素符号);该晶胞中硒原子所处空隙类型为______________(填“立方体”、“正四面体”或正八面体”),该种空隙的填充率为____________;若该晶胞密度为pg·cm-3,硒化锌的摩尔质量为Mg·mol-1。用NA代表阿伏加德罗常数的数值,则晶胞参数a为_____nm。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某纯碱样品中含有氯化钠杂质,用下图装置测定试样中纯碱的纯度。主要实验步骤如下:
①按图组装仪器并检查装置的气密性
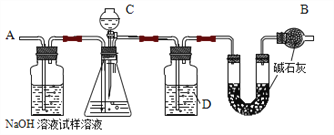
②将 a g 样品放入锥形瓶,加适量水溶解。
③称量装有碱石灰的 U 形管的质量为 b g
④从C 滴下溶液到锥形瓶中无气泡产生
⑤从A 处缓缓鼓入一定量空气后,最终称得U 形管的质量为 c g
(1)B 仪器的名称是_____,其作用为_____。
(2)C 中装的溶液是_____(填字母,下同)D 中装的溶液是_____。
a.稀硫酸 b.浓硫酸 c.氢氧化钠溶液 d.浓盐酸
(3)步骤⑤的目的是_____。
(4)写出纯碱的纯度的计算式_____(用字母表示)。
(5)若实验中发现装置 C 的活塞没塞紧,存在漏气情况,则所测得的结果会_____(填“偏大”、“偏小”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述表示可逆反应N2 + 3H2 ![]() 2NH3一定处于平衡状态的是
2NH3一定处于平衡状态的是
A. N2、H2、NH3的百分含量相等
B. 单位时间,消耗a mol N2的同时消耗3a mol H2
C. 单位时间,消耗a molN2的同时生成3a mol H2
D. 反应若在定容的密器中进行,温度一定时,压强不随时间改变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关叙述正确的是
①水的摩尔质量是18g
②0.5molH2的体积为11.2L
③1 mol 水中含有 2 mol 氢和 1mol 氧
④1mol 任何物质都约含有6.02×1023个分子
⑤0.5mol H2SO4含有的原子数目为3.5NA
⑥只有在标准状况下,体积相同的任何气体所含的分子数相同
⑦质量分数为40%的硫酸溶液与等体积的水混合,所得溶液浓度大于20%
⑧物质的量浓度为4mol/L 的硫酸溶液与等质量的水混合,所得溶液浓度小于2mol/L
A. ①③④⑤⑦⑧ B. ②⑤⑦⑧ C. ⑤⑦⑧ D. ⑤⑦
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】白头翁素衍生物H是一种具有抗菌作用的化合物,实验室由芳香化合物A制备H的一种合成路线如下:
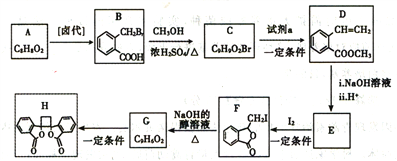
已知:i.RCH2Br![]() R-CH=CH-R
R-CH=CH-R
ii.2R-CH=CH-R'![]()
 (以上R、R'代表氢或烃基等)
(以上R、R'代表氢或烃基等)
(1)A的化学名称是_____________。C中所含官能团的名称为_______________。
(2)试剂a是____________________,G生成H的反应类型是_____________________。
(3)由F生成G的化学方程式是_______________________________。
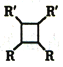
(4)D的同分异构体中,能同时满足下列条件的共有_______种(不含立体结构);
①苯环上只有两个取代基
②能使溴的四氯化碳溶液褪色
③既能发生银镜反应又能发生水解反应且水解产物之一能与氯化铁溶液发生显色反应,其中核磁共振氢谱为五组峰的有机物的结构简式为_________________________。
(5)以乙醇为起始原料,结合已知信息选用必要的无机试剂合成 ,写出合成路线_________________(用简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)。
,写出合成路线_________________(用简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】德国化学家哈伯从1902 年开始研究由氮气和氢气直接合成氨,反应原理为:N2(g)+3H2(g)![]() 2NH3(g) △H=-92.4kJmol-1
2NH3(g) △H=-92.4kJmol-1
(1)在恒温恒容条件下,向反应平衡体系中充入氮气,达到新平衡时,c(H2)将_________(填“增大”、“减小”、“不变”或“无法判断”,下同),c(N2)·c3(H2)将___________。
(2)工业上可用CH4与水蒸气制氢气:CH4(g)+H2O(g)![]() CO(g)+3H2(g)。在200℃时2L的密闭容器中,将1molCH4和1mol H2O(g)混合,达平衡时CH4 的转化率为80%。则200℃时该反应的平衡常数K=______________(保留一位小数)。
CO(g)+3H2(g)。在200℃时2L的密闭容器中,将1molCH4和1mol H2O(g)混合,达平衡时CH4 的转化率为80%。则200℃时该反应的平衡常数K=______________(保留一位小数)。
(3)如图为合成氨反应在不同温度和压强、使用相同催化剂条件下,初始时氮气、氢气的体积比为1:3 时,平衡混合物中氨的体积分数。若分别用vA(NH3)和vB(NH3)表示从反应开始至达平衡状态A、B 时的化学反应速率,则vA(NH3)____ ( 填“>”“<”或“=”)vB(NH3)。

(4)工业生产中逸出的氨可用稀硫酸吸收。若恰好生成NH4HSO4,该溶液中各离子的物质的量浓度由大到小的顺序是______________________。
(5)H2NCOONH4是工业合成尿素的中间产物,该反应的能量变化如图所示,用CO2和氨合成尿素的热化学方程式为_________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com