
【题目】下列说法正确的是
A.氢氧化钠的摩尔质量是40g
B.“物质的量浓度”可简称为“量浓度”
C.阿伏加德罗常数的单位是mol-1
D.1 mol任何物质所占体积都是22.4 L
 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案科目:高中化学 来源: 题型:
【题目】25℃时,在含CH3COOH和CH3COOˉ的溶液中,CH3COOH和CH3COOˉ二者中各自所占的物质的量分数(α)随溶液pH变化的关系如图所示。下列说法不正确的是( )![]()

A.在pH<4.76的溶液中,c(CH3COOˉ)<c(CH3COOH)
B.在pH=7的溶液中,α(CH3COOH)=0,α(CH3COOˉ)=1.0
C.在pH>4.76的溶液中,c(CH3COOˉ)与c(OHˉ)之和可大于c(H+)
D.在pH=4.76的溶液中加盐酸,α(CH3COOH)与α(CH3COOˉ)之和保持不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙醇的沸点是78℃,能与水以任意比混溶,易与氯化钙结合生成配合物.乙醚的沸点为34,.6℃,难溶于水,乙醚极易燃烧.实验室制乙醚的反应原理是2CH3CH2OH ![]() CH3CH2﹣O﹣CH2CH3(乙醚)+H2O
CH3CH2﹣O﹣CH2CH3(乙醚)+H2O
实验步骤:
Ⅰ.乙醚的制备
在分液漏斗中加入2mL 95%的乙醇,在一干燥的三颈烧瓶中放入12mL 95%的乙醇,在冷水浴中的冷却下边摇动边缓慢加入12mL浓硫酸,使混合均匀,并加入2粒沸石.实验装置如图:将反应瓶放在电热套上加热,使温度迅速地上升到140℃,开始由分液漏斗慢慢滴加乙醇,控制流速并保持温度在135~140℃之间.待乙醇加完后,继续反应10min,直到温度上升到160℃止.关闭热源,停止反应.
Ⅱ.乙醚的精制
将馏出物倒入分液漏斗中,依次用8mL 15% NaOH溶液、8mL饱和食盐水洗涤,最后再用8mL饱和氯化钙溶液洗涤2次,充分静置后分液.将乙醚倒入干燥的锥形瓶中,用块状无水氯化钙干燥.待乙醚干燥后,加入到蒸馏装置中用热水浴蒸馏,收集33~38℃的馏分.
请根据上述信息,完成下列问题: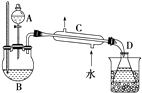
(1)乙醚的制备和精制过程中都需要使用沸石,其作用是 , 如果实验中忘记加沸石,需要怎么处理? .
(2)乙醚的制备和精制过程中都需要使用温度计,其水银球位置是否相同?(填“是”或“否”),原因是
(3)仪器C的名称为 .
(4)如果温度太高,将会发生副反应,产物是 .
(5)精制乙醚中,加入15% NaOH溶液的作用是 , 加入饱和氯化钙溶液的作用是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇是重要的化工原料,又可作为燃料。工业上利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主反应如下:
①CO(g)+2H2(g) ![]() CH3OH(g) ΔH1
CH3OH(g) ΔH1
②CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) ΔH=-58 kJ/mol
CH3OH(g)+H2O(g) ΔH=-58 kJ/mol
③CO2(g)+H2(g) ![]() CO(g)+H2O(g) ΔH=+41 kJ/mol
CO(g)+H2O(g) ΔH=+41 kJ/mol
回答下列问题:
(1)已知反应①中相关的化学键键能数据如下:
化学键 | H-H | C-O | C | H-O | C-H |
E/(kJ·mol-1) | 436 | 343 | 1076 | 465 | x |
则x=。
(2)若将lmol CO2和2mol H2充入容积为2L的恒容密闭容器中,在两种不同温度下发生反应②。测得CH3OH的物质的量随时间的变化如图所示。
①曲线I、Ⅱ对应的平衡常数大小关系为KIKⅡ(填“>”或“=”或“<”);
②一定温度下,能判断该反应达到化学平衡状态的是。
a.容器中压强不变 b.甲醇和水蒸气的体积比保持不变
c.v正(H2)=3v逆(CH3OH) d.2个C=O断裂的同时有6个H—H断裂
③若5min后反应达到平衡状态,H2的转化率为90%,则用CO2表示的平均反应速率为 , 该温度下的平衡常数为;若容器容积不变,下列措施可增加甲醇产率的是。
a.缩小反应容器的容积 b.使用合适的催化剂
c.充入He d.按原比例再充入CO2和H2
(3)以甲醇为燃料,氧气为氧化剂,KOH溶液为电解质溶液,可制成燃料电池。以此电池作电源,在实验室中模拟铝制品表面“钝化”处理过程(装置如图所示)。其中物质b是 , 阳极电极反应为。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面是用硫酸钙生产硫酸、漂白粉等一系列物质的流程图.下列说法正确的是( ) 
A.CO、SO2、SO3均是酸性氧化物
B.图示转化反应均为氧化还原反应
C.工业上利用Cl2和澄清石灰水反应来制取漂白粉
D.用CO合成CH3OH,原子利用率为100%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下的恒温恒容容器中,当下列物理量不再发生变化时,反应:A(g)+3B(g)2C(g)+D(g)不能表明已达平衡状态的是( )
A.混合气体的压强
B.混合气体的密度
C.B的物质的量浓度
D.气体总物质的量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碱性锌锰电池是最常见的一次电池,它的总反应如下:Zn+2MnO2+2H2O=Zn(OH)2+2MnOOH由此可知,该电池放电时的负极材料是( )
A.Zn
B.Zn(OH)2
C.MnO2
D.MnOOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下图所给信息,得出的结论正确的是( ) 
A.碳的燃烧热为b kJ/mol
B.2C(s)+O2(g)═2CO(g)△H=﹣2(b﹣a) kJ/mol
C.2CO2(s)═2CO(g)+O2(g)△H=+a kJ/mol
D.C(s)+O2(g)═CO2(g)△H<﹣b kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下某容积不变的密闭容器中,可逆反应C(s)+H2O(g)![]() CO(g)+H2(g)可建立平衡状态。下列状态中不能确定该反应已达到平衡状态的是( )
CO(g)+H2(g)可建立平衡状态。下列状态中不能确定该反应已达到平衡状态的是( )
A. 体系的压强不再发生变化 B. v正(CO)=v逆(H2O)
C. 生成n mol CO的同时生成n mol H2 D. 1 mol H—H键断裂的同时断裂2 mol H-O键
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com