
【题目】设NA为阿伏加罗常数的值,下列说法正确的是( )
A.标准状况下,22.4 L H2O中含有氢原子数目为2NA
B.17 g NH3所含质子数为10NA
C.0.1 mol Cu(NO3)2中含有的离子数目为0.2NA
D.28 g N2体积为22.4L
 同步练习强化拓展系列答案
同步练习强化拓展系列答案科目:高中化学 来源: 题型:
【题目】铬的化合物在医药、材料领域有重要作用,认识铬及其化合物有重要意义。
(1)基态铬原子中,电子占据的最高能级符号为_____________。
(2)研究表明,当化合物的阳离子有未成对电子时,该化合物具有磁性。下列物质可用作录音带磁粉的是__________。
A.V2O5 B.Fe2O3 C.ZnO D.CrO2
(3)已知Cr3+在水溶液中的存在形式为[Cr(H2O)6]3+。在不同条件下,可从CrCl3水溶液中获得紫色、蓝绿色或绿色等不同颜色的配合物,其实验式均为CrCl36H2O。现取蓝绿色配合物0.1mol,加入足量AgNO3溶液,经过滤、洗涤、干燥得28.7g沉淀,则该化合物中的化学键类型有___________,写出该蓝绿色配合物的电离方程式:________。
(4)常温下,氯化酰铬(CrO2Cl2)是暗红色液体,能与CCl4、CS2等有机溶剂互溶。
①固体氯化酰铬属于______(填“极性”或“非极性”)分子,判断依据是______。
②等电子体是具有相同的价电子数和原子数的分子或离子。写出一种与CCl4分子互为等电子体的阴离子:_______(填化学式);写出CS2分子的电子式:____________。
(5)氮化铬(CrN)在超级电容器领域有良好应用前景,其晶体结构类型与氯化钠相同。
①氮化铬的熔点比氯化钠高的主要原因是______。
②与Cr3+次邻近的N3–有________个。
③已知Cr3+和N3–半径分别为apm、bpm,设Cr3+和N3–都是紧密接触的刚性小球,NA代表阿伏加德罗常数的值,晶体的密度为ρgcm–3,则CrN的摩尔质量为______。(用含a、b、NA、ρ的算式表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用如图电解装置将雾霾中的SO2、NO转化为(NH4)2SO4,用其作为一种优良的氮肥。下列有关说法正确的是
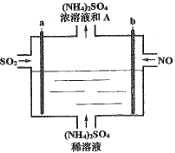
A.每处理lmol NO可以生成2mol A
B.a与电源负极相连,发生还原反应
C.通电后阳极附近溶液的pH增大
D.理论上将SO2与NO以体积比2∶5通入装置可彻底转化
查看答案和解析>>
科目:高中化学 来源: 题型:
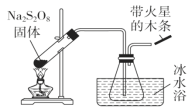
【题目】过硫酸钠(Na2S2O8)具有极强的氧化性,且不稳定,某化学兴趣小组探究过硫酸钠的相关性质,实验如下。已知SO3是无色易挥发的固体,熔点16.8℃,沸点44.8℃。
(1)稳定性探究(装置如图):
分解原理:2Na2S2O8![]() 2Na2SO4+2SO3↑+O2↑。
2Na2SO4+2SO3↑+O2↑。
此装置有明显错误之处,请改正:______________________,水槽冰水浴的目的是____________________;带火星的木条的现象_______________。
(2)过硫酸钠在酸性环境下,在Ag+的催化作用下可以把Mn2+氧化为紫红色的离子,所得溶液加入BaCl2可以产生白色沉淀,该反应的离子方程式为______________________,该反应的氧化剂是______________,氧化产物是________。
(3)向上述溶液中加入足量的BaCl2,过滤后对沉淀进行洗涤的操作是___________________________。
(4)可用H2C2O4溶液滴定产生的紫红色离子,取20mL待测液,消耗0.1mol·L-1的H2C2O4溶液30mL,则上述溶液中紫红色离子的浓度为______mol·L-1,若Na2S2O8有剩余,则测得的紫红色离子浓度将________(填“偏高”“偏低”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知常温下,酸性:HF>HCN,分别向1L1mol/L的HF和HCN溶液中加NaOH固体调节pH(忽略温度和溶液体积的变化),溶液中的(X表示F或CN)随pH变化如图所示,下列说法正确的是
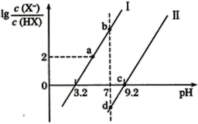
A.HF的电离常数Ka(HF)的数量级10-4
B.d点溶液中:c(Na+)=c(X-)>c(HX)
C.a到b点的过程中水的电离程度先变大后变小
D.b点溶液和d点溶液中c(Na+):b<d
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质在水溶液中的电离方程式书写错误的是( )
A. NaHCO3===Na++H++![]()
B. NH4NO3===![]() +
+![]()
C. NaHSO4===Na++H++![]()
D. Ba(OH)2===Ba2++2OH﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草酸亚铁,在形成晶体时会结晶一定量的水;在工农业生产中具有重要用途,如照相的显影剂,生产磷酸铁锂电池的原料等。
已知:①草酸亚铁不溶于水,可溶于酸;②Fe(SCN)63-+3C2O42-=Fe(C2O4)33-+6SCN-。
回答下列问题:
Ⅰ.甲同学检查药品发现该晶体显浅黄色,认为晶体不纯,可能是因为部分的铁被氧化。为验证自己的猜想,进行实验验证。取少量的晶体样品溶于稀硫酸,滴加KSCN溶液,溶液无明显变化。由此认为晶体中不存在+3价的铁。你认为_______(填“正确”或“不正确”),理由是___________________________________。
Ⅱ.乙同学为测定草酸亚铁晶体FeC2O4﹒xH2O中的结晶水含量,利用如下装置:
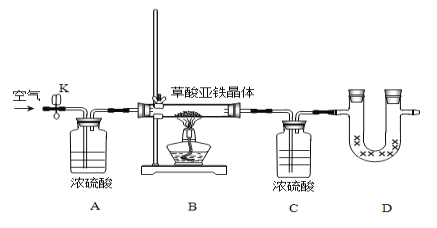
①做实验前首先要_____________________________;
②称取一定质量的晶体,装好药品,开始实验接下来的实验步骤依次为____________________,重复实验直至B中恒重。
a.点燃酒精灯,加热 b.熄灭酒精灯 c.关闭K d.打开K,缓缓通入空气 e.冷却至室温 f.称量
Ⅲ.丙同学用滴定的方法也可以测定草酸亚铁晶体中结晶水的含量。取a克草酸亚铁晶体溶入稀硫酸,再把所得溶液稀释成500mL,取出50mL放入锥形瓶,向其中逐滴滴入未知浓度的酸性KMnO4溶液,振荡,发现溶液颜色逐渐变为棕黄色,且有气泡冒出,当溶液颜色突变成浅紫色,停止滴加。接着向溶液中加入稍过量的KI溶液和几滴淀粉溶液,然后再用c mol/L的Na2S2O3溶液滴至终点。几次实验平均耗用Na2S2O3溶液VmL。(2Na2S2O3+I2=Na2S4O6+2NaI)
(1)写出向溶液中滴加酸性KMnO4溶液发生反应的离子方程式_____________________
(2)上述试验中稀释草酸亚铁溶液时除烧杯和玻璃棒外,还必需的玻璃仪器有__________
(3)x=_______________
(4)若实验中滴入KMnO4溶液过多,则所得x值___________(填偏大、偏小或无影响)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家研制出了一种漂白效率极高的新型漂白剂(结构如图所示),其中W、X、Y、Z均为短周期元素且原子序数依次增大。常温下,0.1mol/LZ的氢化物的水溶液pH=1,且Z与Y位于不同周期。下列叙述正确的是( )

A.原子半径:Z>Y>X>W
B.氢化物的沸点:Y>X>Z>W
C.X的氧化物的水化物是强酸
D.Y的某种单质具有杀菌消毒作用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应2A(g)![]() 2B(g)+C(g)在恒压的密闭容器中反应,下列选项中不能说明反应已达到平衡状态的是( )
2B(g)+C(g)在恒压的密闭容器中反应,下列选项中不能说明反应已达到平衡状态的是( )
A. 容器内气体密度不再改变的状态
B. v(A):v(B):v(C)=2:2:1
C. c(A):c(B):c(C)的值保持不变
D. 混合气体的平均相对分子质量不再改变的状态
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com