
(16分)配 制200mL0.5 mol·L-1的NaOH溶液,请回答下列问题:
制200mL0.5 mol·L-1的NaOH溶液,请回答下列问题:
Ⅰ、请将下述实验步骤中缺少的文字请补充完整
(1)实验中选用的仪器除托盘天平、砝码、镊子、量筒、玻璃棒外还必须用到
仪器。
(2)计算:所需NaOH的质量为 g;
(3)称量:用托盘天平称量时,首先将托盘天平调平,将 放在天平的左盘上称量其质量,再添上 g砝码后,向左盘加NaOH固体到平衡为止;
(4)溶解:向盛有NaOH的烧杯中加入70mL水并用玻璃棒 使其溶解;
(5)转移:将步骤(4)中溶液用玻璃棒 注入容量瓶中,在烧杯中加入少量的水,小心洗涤2—3次后并将洗涤液移入容量瓶中 ;
(6)定容:继续往容量瓶中加水至液面接近刻度线 cm处,改用 加水至刻度线,注意视线与 保持水平,加盖摇匀。
(7)贮存: 将溶液倒入试剂瓶中保存,贴上标签注明溶液的浓度和配制日期。
 期末好成绩系列答案
期末好成绩系列答案 99加1领先期末特训卷系列答案
99加1领先期末特训卷系列答案 百强名校期末冲刺100分系列答案
百强名校期末冲刺100分系列答案科目:高中化学 来源: 题型:阅读理解

 或
或 表示密闭容器;
表示密闭容器;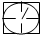 表示气体流速管(单位时间内通过气体的体积恒定,且无除尘和吸收气体作用);
表示气体流速管(单位时间内通过气体的体积恒定,且无除尘和吸收气体作用);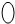 表示棉花;颗粒吸附剂可以吸收可吸入的颗粒;→表示气体的流向.
表示棉花;颗粒吸附剂可以吸收可吸入的颗粒;→表示气体的流向.| 3.2 |
| at |
| 3.2 |
| at |
查看答案和解析>>
科目:高中化学 来源: 题型:
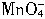 +2H2O=2Mn2++5
+2H2O=2Mn2++5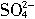 +4H+
+4H+查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 或
或 表示密闭容器;
表示密闭容器;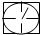 表示气体流速管(单位时间内通过气体的体积恒定,且无除尘和吸收气体作用);
表示气体流速管(单位时间内通过气体的体积恒定,且无除尘和吸收气体作用); 表示棉花;颗粒吸附剂可以吸收可吸入的颗粒;→表示气体的流向.
表示棉花;颗粒吸附剂可以吸收可吸入的颗粒;→表示气体的流向.查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题



查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com