
| A. | 周期表中碱金属元素从上到下,其单质的还原性逐渐增强,熔沸点逐渐升高 | |
| B. | 分别在Na2CO3和NaHCO3两种物质的溶液中,加入少量Ba(OH)2溶液,能鉴别这两种物质 | |
| C. | 向品红溶液中同时通入相同物质的量的SO2和Cl2,溶液不褪色 | |
| D. | 向某溶液中加入硝酸钡溶液和稀硝酸,有白色沉淀产生.证明原溶液中一定含有SO42- |
分析 A.碱金属元素从上到下,半径增大,金属键减弱;
B.二者均与Ba(OH)2溶液反应生成白色沉淀;
C.相同物质的量的SO2和Cl2,发生氧化还原反应生成硫酸和盐酸;
D.白色沉淀为硫酸钡,但亚硫酸根离子与硝酸钡溶液和稀硝酸,也反应生成硫酸钡白色沉淀.
解答 解:A.碱金属元素从上到下,半径增大,金属键减弱,熔沸点逐渐降低,而碱金属元素从上到下,其单质的还原性逐渐增强,故A错误;
B.二者均与Ba(OH)2溶液反应生成白色沉淀,现象相同,不能鉴别,故B错误;
C.相同物质的量的SO2和Cl2,发生氧化还原反应生成硫酸和盐酸,则品红不褪色,故C正确;
D.白色沉淀为硫酸钡,但亚硫酸根离子与硝酸钡溶液和稀硝酸,也反应生成硫酸钡白色沉淀,则原溶液中可能含SO42-或SO32-,或二者均存在,故D错误;
故选C.
点评 本题考查物质的鉴别,为高频考点,把握物质的性质、发生的反应与现象为解答的关键,侧重分析与应用能力的考查,注意元素化合物知识的应用,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 0.1mol的白磷(P4)或甲烷中所含的共价键数均为0.4NA | |
| B. | 常温下,6.4g由S2、S4、S8组成的混合物含硫原子数为0.2NA | |
| C. | 25℃时,0.lmol/LNa2CO3溶液含Na+数为0.2NA | |
| D. | 标准状况下,Na2O2与足量的CO2反应生成2.24LO2,转移电子为0.4NA |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
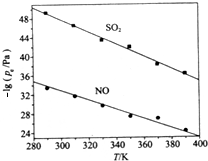 煤燃烧排放的烟气含有SO2和NOx,形成酸雨、污染大气,采用NaClO2溶液作为吸收剂可同时对烟气进行脱硫、脱硝.回答下列问题:
煤燃烧排放的烟气含有SO2和NOx,形成酸雨、污染大气,采用NaClO2溶液作为吸收剂可同时对烟气进行脱硫、脱硝.回答下列问题:| 离子 | SO42- | SO32- | NO3- | NO2- | Cl- |
| c/(mol•L-1) | 8.35×10-4 | 6.87×10-6 | 1.5×10-4 | 1.2×10-5 | 3.4×10-3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2、NO2、NO、SO3 的物质的量一定相等 | |
| B. | NO2和 SO2的物质的量一定相等 | |
| C. | 平衡体系中反应物的总物质的量一定等于生成物的总物质的量 | |
| D. | NO 和 SO3 的物质的量一定相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在船舶的外壳装上锌块可防止其发生电化学腐蚀,叫作外加电流的阴极保护法. | |
| B. | 浓硫酸具有吸水性,因此可用作干燥剂,能干燥氢气、硫化氢、氨气等气体 | |
| C. | FeCl3溶液加热蒸干、灼烧得到Fe2O3 | |
| D. | 用惰性电极分别电解CuCl2溶液和MgCl2溶液分别得到单质Cu和Mg |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该反应中氧化剂是Na2O2,还原剂是FeSO4 | |
| B. | 若Fe2+失去 4mol 电子,生成氧气的体积约为 22.4L | |
| C. | 4molNa2O2 参加反应,共得到 6mol 电子 | |
| D. | 反应过程中可以看到白色沉淀先转化为灰绿色后转化为红褐色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 当1 mol Cu(IO3)2发生反应共转移的电子为10mol | |
| B. | 反应中KI被氧化 | |
| C. | I2是氧化产物CuI是还原产物 | |
| D. | 当1 mol Cu(IO3)2发生反应被Cu2+氧化的I-为2 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
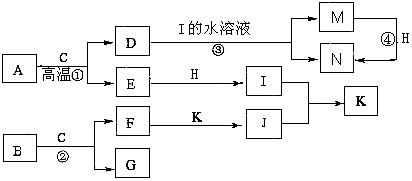
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
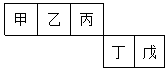 短周期元素甲、乙、丙、丁、戊五种元素在元素周期表中的位置如图所示,其中戊是同周期中原子半径最小的元素.下列有关判断正确的是( )
短周期元素甲、乙、丙、丁、戊五种元素在元素周期表中的位置如图所示,其中戊是同周期中原子半径最小的元素.下列有关判断正确的是( )| A. | 最外层电子数:甲>乙>丙>丁>戊 | |
| B. | 简单离子的离子半径:戊>丁 | |
| C. | 含有丁元素的酸有多种 | |
| D. | 乙的氢化物多种多样,丙、丁、戊的氢化物各有一种 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com