
【题目】下列说法不正确的是![]()
A.ns能级上单个电子的能量不一定高于![]() 能级上单个电子的能量
能级上单个电子的能量
B.基态C原子的电子排布式![]() 违反了洪特规则
违反了洪特规则
C.基态Sc原子的电子排布式![]() 违反了能量最低原理
违反了能量最低原理
D.基态Ti原子的电子排布式![]() 违反了泡利原理
违反了泡利原理
科目:高中化学 来源: 题型:
【题目】电解质的电导率越大,导电能力越强。用0.100mol·L-1的KOH溶液分别滴定体积均为20.00mL、浓度均为0.100molL-1的盐酸和CH3COOH溶液。利用传感器测得滴定过程中溶液的电导率如图所示。下列说法正确的是( )

A. 曲线②代表滴定CH3COOH溶液的曲线
B. 在相同温度下,P点水电离程度大于M点
C. M点溶液中:c(CH3COO-)+c(OH-)-c(H+)=0.1mol·L-1
D. N点溶液中:c(K+)>c(OH-)>c(CH3COO-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】机动车排放的污染物主要有碳氢化合物、一氧化碳和氮氧化物等。
I.汽油燃油车上安装三元催化转化器,可有效降低汽车尾气污染。
(1)已知: C(s)+O2(g) = CO2(g) △H1 = 393.5kJ·mol1
2C(s)+O2(g) = 2CO(g) △H2 = 221.0 kJ·mol1
N2(g)+O2(g) = 2NO(g) △H 3 =+180.5 kJ·mol1
CO和NO两种尾气在催化剂作用下生成N2的热化学方程式是_________________________。
(2)研究CO和NO的催化反应,用气体传感器测得在某温度下、一定体积的密闭容器中,不同时间NO和CO浓度如下表:
时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
c(NO)/(______)4mol·L1) | 10.0 | 4.50 | 2.50 | 1.50 | 1.00 | 1.00 |
c(CO)/(______)3mol·L1) | 3.60 | 3.05 | 2.85 | 2.75 | 2.70 | 2.70 |
① 前4 s内的平均反应速率υ(CO) =______mol·L1·s1。
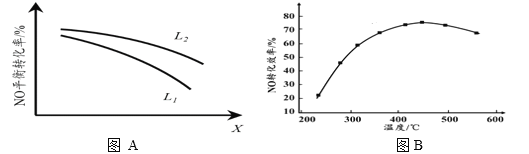
② L、X可分别代表压强或温度。下图A表示L一定时,NO(g)的平衡转化率随X的变化关系。X代表的物理量是______。判断L1、L2的大小关系,并简述理由:______________________________。
(3)实验测得,v正=k正·c2(NO)·c2(CO),v逆=k逆·c(N2) ·c2(CO2)(k正、k逆为速率常数,只与温度有关)。
①达到平衡后,仅升高温度,k正增大的倍数______(填“>”、“<
②若在2 L的密闭容器中充入1 mol CO和1 mol NO,在一定温度下达到平衡时,CO的转化率为40%,则k正︰k逆 =___________。(保留一位小数)
II. 有人利用反应C(s)+2NO(g) ![]() N2(g)+CO2(g) ΔH = 34.0 kJ·mol1,用活性炭对NO进行吸附。现在密闭容器中加入足量的C和一定量的NO气体并在催化剂作用下发生反应,经相同时间测得NO的转化率随温度的变化如图B所示。由图可知最高转化率对应温度为450℃。低于450℃时,NO的转化率是不是对应温度下的平衡转化率及判断理由是________________________;
N2(g)+CO2(g) ΔH = 34.0 kJ·mol1,用活性炭对NO进行吸附。现在密闭容器中加入足量的C和一定量的NO气体并在催化剂作用下发生反应,经相同时间测得NO的转化率随温度的变化如图B所示。由图可知最高转化率对应温度为450℃。低于450℃时,NO的转化率是不是对应温度下的平衡转化率及判断理由是________________________;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】纳米级Cu2O由于具有优良的催化性能而受到关注。采用离子交换膜控制电解液中OH一的浓度制备纳米级Cu2O的装置如图所示,发生的反应为:2Cu+H2O![]() Cu2O+H2↑。下列说法正确的是
Cu2O+H2↑。下列说法正确的是
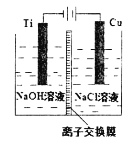
A.钛电极发生氧化反应
B.阳极附近溶液的pH逐渐增大
C.离子交换膜应采用阳离子离子交换膜
D.阳极反应式是:2Cu+2OH一一2e一== Cu2O+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,将1molA(g)和1molB(g)充入2L密闭容器中发生反应:A(g)+B(g) ![]() xC(g)+D(s)△H<0,在 t1 时达平衡。在 t2 、t3 时刻分别改变反应的一个条件,测得容器中 C(g)的浓度随时间变化如图所示。下列有关说法正确的是
xC(g)+D(s)△H<0,在 t1 时达平衡。在 t2 、t3 时刻分别改变反应的一个条件,测得容器中 C(g)的浓度随时间变化如图所示。下列有关说法正确的是
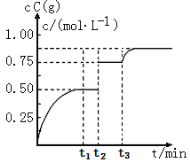
A. t2 时刻改变的条件是使用催化剂
B. t3时刻v(逆)可能小于t2 时刻v(逆)
C. t3时刻改变的条件一定是增大反应物的浓度
D. t1~t2、t2~t3平衡常数均为0.25
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列由电子排布式所得的结论错误的是![]()
选项 | 电子排布式 | 结论 |
A |
| 违背洪特规则 |
B |
| 违背能量最低原理 |
C |
| 违背泡利原理 |
D |
| 违背能量最低原理 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用H2还原WO3制备金属W的装置如图所示(Zn粒中往往含有硫等杂质,焦性没食子酸溶液用于吸收少量氧气),下列说法正确的是
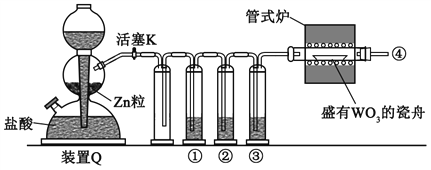
A. ①、②、③中依次盛装KMnO4溶液、浓H2SO4、焦性没食子酸溶液
B. 管式炉加热前,用试管在④处收集气体并点燃,通过声音判断气体纯度
C. 结束反应时,先关闭活塞K,再停止加热
D. 装置Q(启普发生器)也可用于二氧化锰与浓盐酸反应制备氯气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在某温度下,可逆反应mA(g)+nB(g)![]() pC(g)+qD(g);△H<0的平衡常数为K,下列说法正确的是( )
pC(g)+qD(g);△H<0的平衡常数为K,下列说法正确的是( )
A.增加A的量,平衡正向移动,达到新平衡时K值增大
B.升高温度,K值增大
C.K越大,说明该反应的进行程度越大
D.该反应的K= 
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,AgCl的溶解平衡曲线如图所示。已知pAg=-lg c(Ag+)、pCl=-lg c(Cl-),利用pCl、pAg的坐标系可表示出AgCl的溶度积与溶液中c(Ag+)和c(Cl-)的相互关系。下列说法错误的是
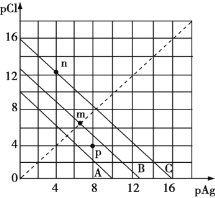
A. A线、B线、C线对应的温度关系:A>B>C
B. A线对应温度下,AgCl的Ksp=1×10-10
C. B线对应温度下,p点形成的溶液是AgCl的不饱和溶液
D. C线对应温度下,n点表示KCl与过量的AgNO3反应产生AgCl沉淀
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com