
物质的量相同的下列物质分别与足量的金属钠反应,在相同状况下,生成H2体积最大的是( )
A.C2H5OH B.![]()
![]()
 小学期末标准试卷系列答案
小学期末标准试卷系列答案科目:高中化学 来源: 题型:阅读理解
| ||
| ||
| △ |
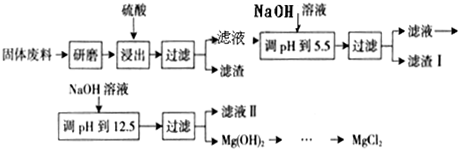
| 沉淀物 | Fe(OH)3 | Al(OH)3 | Mg(OH)2 |
| PH | 3.2 | 5.2 | 12.4 |
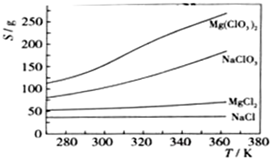
查看答案和解析>>
科目:高中化学 来源: 题型:
(19分)
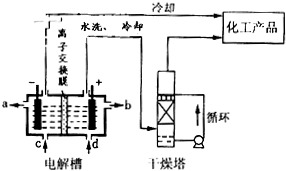
Ⅰ.用碳棒作电极,电解下列水溶液:①Na2SO4溶液②AgNO3溶液③KCl溶液 ④CuCl2溶液。通过相同电量时,阴极产生的气体物质的量相同的是(填序号)_________;通过相同电量时,产生的气体总物质的量由多到少的排列顺序是(填序号)__________。
Ⅱ.到目前为止,由化学能转变的热能或电能仍然是人类使用的最主要的能源。
(1)化学反应中放出的能量(焓变,△H)与反应物和生成物的键能(E)有关。
已知:H2(g)+Cl2(g)=2HCl(g) △H=-185 KJ/mol
E(H-H)=436 KJ/mol, E(Cl-Cl)=247 KJ/mol, 则E(H-Cl)=_____
(2)已知Fe2O3(s)+3CO(g)=2Fe(s)+3CO2 (g) △H=-25 KJ/mol
3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g) △H=-47 KJ/mol
Fe3O4(s)+CO(g)=3FeO(s)+CO2(g) △H=+19 KJ/mol
请写出CO还原FeO的热化学方程式:_________________________________。
(3)如图所示的装置:
该装置中Cu极为_____极;当铜片的质量变化了12.8g时,a极上消耗的O2在标准状况下的体积为_______L。
查看答案和解析>>
科目:高中化学 来源:2010-2011学年河南省焦作市高二上学期期末考试化学试卷 题型:填空题
(19分)
Ⅰ.用碳棒作电极,电解下列水溶液:①Na2SO4溶液②AgNO3溶液③KCl溶液④CuCl2溶液。通过相同电量时,阴极产生的气体物质的量相同的是(填序号)_________;通过相同电量时,产生的气体总物质的量由多到少的排列顺序是(填序号)__________。
Ⅱ.到目前为止,由化学能转变的热能或电能仍然是人类使用的最主要的能源。
(1)化学反应中放出的能量(焓变,△H)与反应物和生成物的键能(E)有关。
已知:H2(g)+Cl2(g)=2HCl(g) △H=-185 KJ/mol
E(H-H)=436 KJ/mol, E(Cl-Cl)=247 KJ/mol,则E(H-Cl)=_____
(2)已知Fe2O3(s)+3CO(g)=2Fe(s)+3CO2 (g) △H=-25 KJ/mol
(g) △H=-25 KJ/mol
3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g) △H=-47 KJ/mol
Fe3O4(s)+CO(g)=3FeO(s)+CO2(g) △H=+19 KJ/mol
请写出CO还原FeO的热化学方程式:_________________________________。
(3)如图所示的装置:
该装置中Cu极为_____极;当铜片的质量变化了12.8g时,a极上消耗的O2在标准状况下的体积为_______L。
查看答案和解析>>
科目:高中化学 来源:2012届河南省焦作市高二上学期期末考试化学试卷 题型:填空题
(19分)
Ⅰ.用碳棒作电极,电解下列水溶液:①Na2SO4溶液 ②AgNO3溶液 ③KCl溶液 ④CuCl2溶液。通过相同电量时,阴极产生的气体物质的量相同的是(填序号)_________;通过相同电量时,产生的气体总物质的量由多到少的排列顺序是(填序号)__________。
Ⅱ.到目前为止,由化学能转变的热能或电能仍然是人类使用的最主要的能源。
(1)化学反应中放出的能量(焓变,△H)与反应物和生成物的键能(E)有关。
已知:H2(g)+Cl2(g)=2HCl(g) △H=-185 KJ/mol
E(H-H)=436 KJ/mol, E(Cl-Cl)=247 KJ/mol, 则E(H-Cl)=_____
(2) 已知Fe2O3(s)+3CO(g)=2Fe(s)+3CO2 (g) △H=-25 KJ/mol
3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g) △H=-47 KJ/mol
Fe3O4(s)+CO(g)=3FeO(s)+CO2(g) △H=+19 KJ/mol
请写出CO还原FeO的热化学方程式:_________________________________。
(3)如图所示的装置:

该装置中Cu极为_____极;当铜片的质量变化了12.8g时,a极上消耗的O2在标准状况下的体积为_______L。
查看答案和解析>>
科目:高中化学 来源: 题型:
Ⅰ.用碳棒作电极,电解下列水溶液:①Na2SO4溶液 ②AgNO3溶液 ③KCl溶液 ④CuCl2溶液。通过相同电量时,阴极产生的气体物质的量相同的是(填序号)_________;通过相同电量时,产生的气体总物质的量由多到少的排列顺序是(填序号)__________。
Ⅱ.到目前为止,由化学能转变的热能或电能仍然是人类使用的最主要的能源。
(1)化学反应中放出的能量(焓变,△H)与反应物和生成物的键能(E)有关。
已知:H2(g)+Cl2(g)=2HCl(g) △H=-185 KJ/mol
E(H-H)=436 KJ/mol, E(Cl-Cl)=247 KJ/mol, 则E(H-Cl)=_____
(2) 已知Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) △H=-25 KJ/mol
3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g) △H=-47 KJ/mol
Fe3O4(s)+CO(g)=3FeO(s)+CO2(g) △H=+19 KJ/mol
请写出CO还原FeO的热化学方程式:_________________________________。
(3)如图所示的装置:
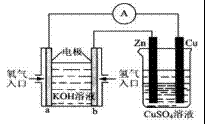
该装置中Cu极为_____极;当铜片的质量变化了12.8g时,a极上消耗的O2在标准状况下的体积为_______L。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com