
| ||
| 0.56L |
| 22.4L/mol |
| 2×84 |
| mg |
| 44 | ||
|
| 4.2g |
| ag |
| 420 |
| a |
| 2×84 |
| mg |
| 88 |
| 6.93g |
| 13.23g |
| 3ag |
| 441 |
| a |
| 420 |
| a |
| 441 |
| a |


 浙大优学小学年级衔接导与练浙江大学出版社系列答案
浙大优学小学年级衔接导与练浙江大学出版社系列答案 小学暑假作业东南大学出版社系列答案
小学暑假作业东南大学出版社系列答案 津桥教育暑假拔高衔接广东人民出版社系列答案
津桥教育暑假拔高衔接广东人民出版社系列答案 波波熊暑假作业江西人民出版社系列答案
波波熊暑假作业江西人民出版社系列答案科目:高中化学 来源: 题型:
| A、生成物的总能量总是低于反应物的总能量 |
| B、应用盖斯定律,可计算某些难以直接测量的反应热 |
| C、化学反应中的能量变化都表现为热量变化 |
| D、需要加热才能发生的反应一定是吸热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
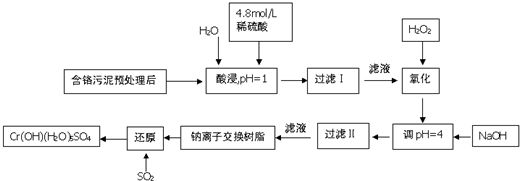
| 阳离子 | Fe3+ | Fe2+ | Mg2+ | Al3+ | Ca2+ | Cr3+ |
| 开始沉淀时的pH | 1.9 | 7.0 | 9.6 | 4.2 | 9.7 | - |
| 沉淀完全时的pH | 3.2 | 9.0 | 11.1 | 8.0 | 11.7 | 9.0(>9.0溶解) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、该粉末中一定含有Al(NO3)3、KOH、NaCl |
| B、该粉末中一定含有Al(NO3)3、和KOH,但不能确定是否含有NaCl |
| C、该粉末中一定含有NaCl,但不能确定是否含有Al(NO3)3、和KOH |
| D、以上过程不能确定该溶液中含有哪种物质 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 操作 | 现象 |
| a.用干燥洁净的烧杯取约10mL浓硝酸,加热. |  |
| b.把小块烧红的木炭迅速伸入热的浓硝酸中. | 红热的木炭与热的浓硝酸接触发生剧烈反应,同时有大量红棕色气体产生,液面上木炭迅速燃烧,发出光亮. |
查看答案和解析>>
科目:高中化学 来源: 题型:
 A、B、C、D、E为短周期元素,且原子序数依次递增.其中B元素形成化合物种类最多,A、E同主族.A与 E的质子数之和是B质子数的2倍,且E与D分别形成的最简单离子都含有10个电子.由以上元素组成的物质BD和C2具有相同的电子数.
A、B、C、D、E为短周期元素,且原子序数依次递增.其中B元素形成化合物种类最多,A、E同主族.A与 E的质子数之和是B质子数的2倍,且E与D分别形成的最简单离子都含有10个电子.由以上元素组成的物质BD和C2具有相同的电子数.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
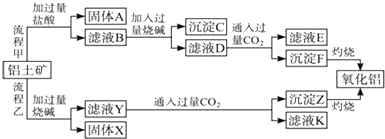
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com