
| 阳离子 | K+ Na+ Fe2+ Ba2+ NH4+ |
| 阴离子 | OH- NO3- I- HCO3- AlO2- HSO4- |
| ||
| ||


科目:高中化学 来源: 题型:
| 待鉴别的物质 | 鉴别方法 | |
| A | 工业酒精、白醋、食盐水 | 用口尝 |
| B | N2、O2、CO2、空气 | 用燃着的木条检验,观察木条燃烧情况 |
| C | 棉纤维、丝绸、涤纶 | 灼烧,闻燃烧产生的气味,观察燃烧情况和灰烬 |
| D | 化肥:氯化钾、硫酸钾、磷矿粉[Ca3(PO4)2] | 看外观,再加水,观察是否溶于水 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
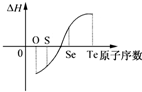 某化学兴趣小组专门研究了氧族元素及其某些化合物的部分性质.所查资料信息如下:
某化学兴趣小组专门研究了氧族元素及其某些化合物的部分性质.所查资料信息如下:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.01mol/L的H2A溶液 |
| B、0.01mol/L的NaHA溶液 |
| C、0.02mol/L的NaOH溶液与0.02mol/L的NaHA溶液等体积混合 |
| D、0.02mol/L的HCl溶液与0.04mol/L的NaHA溶液等体积混合 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、18g水中含有电子数为10NA |
| B、16g氧气所含原子数为NA |
| C、4.8g金属镁变成镁离子时失去电子数为0.2NA |
| D、46g二氧化氮和46g四氧化二氮含有的原子数均是3NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com