
【题目】常温下,用某浓度的NaOH溶液滴定20.00 mL等浓度的CH3COOH溶液,所得滴定曲线如图。下列说法正确的是( )

A.c点溶液中c(Na+)∶c(CH3COO-)=1∶1
B.a、b两点对应的醋酸的电离平衡常数:a<b
C.a点醋酸溶液的浓度为1.0×10–3 mol·L–1
D.升高温度,d点溶液pH不变
【答案】A
【解析】
由图可知原醋酸溶液的物质的量浓度大于1.0×10-3mol/L,c点溶液呈中性则有c(H+)=c(OH-)。
A. c点溶液呈中性,则c(H+)=c(OH-),根据电荷守恒可得![]() ,所以 c(Na+)= c(CH3COO-),故A正确;
,所以 c(Na+)= c(CH3COO-),故A正确;
B.醋酸的电离平衡常数只和温度有关,该反应在常温下进行,a、b两点温度相同,则醋酸的电离平衡常数相等,故B错误;
C.醋酸为弱电解质,在水中部分电离,a点未滴加NaOH溶液,醋酸溶液的pH=3,则醋酸的浓度大于1.0×10-3mol/L.,故C错;
D.d点溶液中的溶质为CH3COONa,CH3COO-水解生成OH-使溶液pH>7,温度升高,促进CH3COO-水解,溶液中OH-浓度增大,溶液pH增大,故D错误;
故答案为A。


科目:高中化学 来源: 题型:
【题目】Na3OCl是一种良好的离子导体,具有反钙钛矿晶体结构。回答下列问题:
(1)Ca小于Ti的是_______(填标号)。
A.最外层电子数 B.未成对电子数 C.原子半径 D.第三电离能
(2)由O、Cl元素可组成不同的单质和化合物,其中Cl2O2能破坏臭氧层。
① Cl2O2的沸点比H2O2低,原因是___________________________________。
② O3分子中心原子杂化类型为_______;O3是极性分子,理由是___________________。
(3)Na3OCl可由以下两种方法制得:
方法Ⅰ Na2O + NaCl![]() Na3OCl
Na3OCl
方法II 2Na + 2NaOH + 2NaCl![]() 2Na3OCl + H2↑
2Na3OCl + H2↑
① Na2O的电子式为____________。
② 在方法Ⅱ的反应中,形成的化学键有_______(填标号)。
A.金属键 B.离子键 C.配位键 D.极性键 E.非极性键
(4)Na3OCl晶体属于立方晶系,其晶胞结构如右所示。已知:晶胞参数为a nm,密度为d g·cm-3。
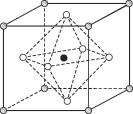
①Na3OCl晶胞中,Cl位于各顶点位置,Na位于_________位置,两个Na之间的最短距离为________nm。
②用a、d表示阿伏加德罗常数的值NA=__________________(列计算式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某冶炼厂利用含ZnO的烟灰脱除工业废气中的SO2,最终得到锌盐。该厂所用烟灰的主要成分如下表所示:
主要成分 | ZnO | CaO | Fe2O3 | SiO2 | 其它 |
质量分数/% | 81 | 0.098 | 1.14 | 0.5 | ———— |
在一定条件下,将含SO2的工业废气通入烟灰浆液(烟灰和水的混合物)进行脱硫,过程中测得pH和上清液中溶解的SO2物质的量浓度[c(SO2)]随时间的变化如图所示:

(1)纯ZnO浆液的pH为6.8,但上述烟灰浆液的初始pH为7.2。在开始脱硫后3 min内(a~b段),pH迅速降至6.8,引起pH迅速变化的原因是_____(结合化学用语解释)。
(2)生产中脱除SO2效果最佳的时间范围是_____(填字母序号)。
A.20~30 min B.30~40 min C.50~60 min D.70~80 min
(3)在脱硫过程中涉及到的主要反应原理:
Ⅰ.ZnO + SO2 === ZnSO3↓
Ⅱ.ZnSO3 + SO2 + H2O === Zn(HSO3)2
①在30~40 min时,主要发生反应II,生成可溶性的Zn(HSO3)2。上清液中c(SO2)上升的原因可能是______。
②在30~80 min时,pH降低的原因可能是______(写出2点)。
③将脱硫后的混合物利用空气氧化技术处理,该过程中发生反应:2ZnSO3 + O2 === 2ZnSO4和______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一个固定体积的密闭容器中,向容器内充入2molA和1molB,发生如下反应:2A(g) + B(g)![]() 3C(g) + D(s),反应达到平衡时C的物质的量浓度为1.2 mol/L。若维持容器的温度和体积不变,按下列方法改变起始物质,达到平衡时C的浓度仍为1.2 mol/L的是
3C(g) + D(s),反应达到平衡时C的物质的量浓度为1.2 mol/L。若维持容器的温度和体积不变,按下列方法改变起始物质,达到平衡时C的浓度仍为1.2 mol/L的是
A.4molA + 2molBB.3molC+ 1molD+ 1molB
C.6molC + 0.8molDD.1.6molA+0.8molB + 0.6molC+0.3molD
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向容积均为0.5L的甲、乙、丙三个密闭容器中分别充入一定量的A和B,发生反应:A(g)+xB(g)![]() 2C(g)。各容器的反应温度、反应物起始量,反应过程中C的浓度随时间变化关系分别如图表所示:
2C(g)。各容器的反应温度、反应物起始量,反应过程中C的浓度随时间变化关系分别如图表所示:
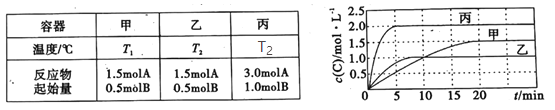
下列说法正确的是( )
A.T1< T2,且该反应为吸热反应
B.x=2
C.若平衡后保持温度不变,改变容器体积平衡不移动
D.该反应正反应的活化能大于逆反应的活化能
查看答案和解析>>
科目:高中化学 来源: 题型:
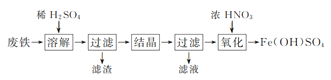
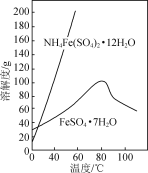
【题目】实验室以工业废铁为原料制取绿矾(FeSO4·7H2O),并用绿矾为原料制备Fe(OH)SO4溶液和NH4Fe(SO4)2·12H2O晶体,其实验流程如下:
已知:FeSO4·7H2O和NH4Fe(SO4)2·12H2O随温度变化的溶解度曲线如下图。
(1)废铁溶解前需要用热的饱和Na2CO3溶液浸泡,目的是________。
(2)溶解时控制溶液温度为70~80 ℃,目的是__________________,溶解时铁需过量的原因是________________。
(3)氧化时将绿矾分批次加入到浓硝酸中,搅拌,反应1 h,有红棕色气体生成,同时得到Fe(OH)SO4,发生的化学方程式为________________。氧化结束后不能采用加热煮沸的方法除去溶液中剩余的硝酸,理由是________________(任写一条)。
(4)设计以绿矾和硫酸铵为原料,制取纯净NH4Fe(SO4)2·12H2O的实验方案:________________(已知pH=1时出现Fe(OH)3沉淀。实验中可以选用的试剂:1.0 mol·L-1稀硫酸、2.0 mol·L-1稀盐酸、5%H2O2溶液)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学平衡移动原理在生产、生活、科研中有重要应用。
(1)生活中明矾[KAl(SO4)2·12H2O]常用作净水剂,其净水的原理是_____(用离子方程式表示)。
(2)工业上在850℃时用钠还原熔融态氯化钾的方法制备金属钾,发生的反应方程式为:Na(l) + KCl(l)![]() NaCl(l) + K(g),能制备钾的原因是_______。
NaCl(l) + K(g),能制备钾的原因是_______。
(3)测得某工厂废水中含Cr2O72–的浓度为3.0×10–4 mol·L1,常温下,对该有害离子的处理流程如下:{已知:绿矾的化学式为FeSO4·7 H2O, Ksp [Cr(OH)3]=6.0×10–31 }

① 步骤(Ⅰ)中发生反应的离子方程式为_________。
② 若忽略加入各种试剂后的废水体积变化,则Cr3+开始沉淀的pH为_________。
(4)为了研究沉淀溶解平衡和沉淀转化,某同学查阅资料并设计如下实验。查阅资料:25℃时,Ksp (AgCl)=1.8×10–10,Ksp (AgI)=8.3×10–17。
操作步骤 | 现象 |
步骤1:向2 mL 0.1 mol·L1AgNO3溶液中加入2 mL 0.1 mol·L1 NaCl溶液,得到浊液a,过滤。 | 得滤液b和白色沉淀c |
步骤2:向滤液b中滴加0.1 mol·L1 KI溶液。 | 出现浑浊 |
步骤3:向白色沉淀c中滴加0.1 mol·L1 KI溶液。 | 白色沉淀变为黄色 |
① 浊液a中存在沉淀溶解平衡(用方程式表示)______________。
② 用化学平衡原理解释步骤3中的实验现象_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素铬(Cr)在溶液中主要以Cr3+(蓝紫色)、Cr(OH)4(绿色)、Cr2O72(橙红色)、CrO42(黄色)等形式存在,Cr(OH)3为难溶于水的灰蓝色固体,回答下列问题:
(1)Cr3+与Al3+的化学性质相似,在Cr2(SO4)3溶液中逐滴加入NaOH溶液直至过量,可观察到的现象是____________。
(2)CrO42和Cr2O72在溶液中可相互转化。室温下,初始浓度为1.0 mol·L1的Na2CrO4溶液中c(Cr2O72)随c(H+)的变化如图所示。

①用离子方程式表示Na2CrO4溶液中的转化反应__________。
②由图可知,溶液酸性增大,CrO42的平衡转化率___________(填“增大“减小”或“不变”)。根据A点数据,计算出该转化反应的平衡常数为___________。
③升高温度,溶液中CrO42的平衡转化率减小,则该反应的ΔH_________0(填“大于”“小于”或“等于”)。
(3)+6价铬的化合物毒性较大,常用NaHSO3将废液中的Cr2O72还原成Cr3+,反应的离子方程式为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用铝土矿(主要成分为Al2O3,含Fe2O3杂质)为原料冶炼铝的工艺流程如下:
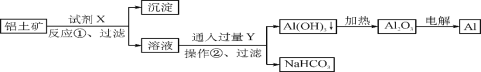
下列叙述正确的是( )
A. 试剂X可以是氢氧化钠溶液,也可以是盐酸
B. 反应①过滤后所得沉淀为氢氧化铁
C. 电解法制取铝单质时也可以采用电解氯化铝以降低成本
D. 反应②的化学方程式为NaAlO2+CO2+2H2O===Al(OH)3↓+NaHCO3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com