
在化学反应5NH4NO3 2HNO3+9H2O+4N2↑中,被氧化的N原子与被还原的N原子个数之比为( )
2HNO3+9H2O+4N2↑中,被氧化的N原子与被还原的N原子个数之比为( )
|
| A. | 3:5 | B. | 5:3 | C. | 5:2 | D. | 1:1 |
考点:
氧化还原反应.
专题:
氧化还原反应专题.
分析:
在5NH4NO3=2HNO3+4N2+9H2O的反应中, H4NO3→
H4NO3→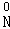 2,NH4
2,NH4 O3→
O3→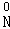 2,从化合价变化的角度判断氧化剂和还原剂,根据氧化还原反应中氧化剂和还原剂之间得失电子数目相等判断发生氧化反应的氮原子与发生还原反应的氮原子的个数之比.
2,从化合价变化的角度判断氧化剂和还原剂,根据氧化还原反应中氧化剂和还原剂之间得失电子数目相等判断发生氧化反应的氮原子与发生还原反应的氮原子的个数之比.
解答:
解:在5NH4NO3=2HNO3+4N2+9H2O的反应中, H4NO3→
H4NO3→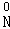 2,﹣3价的N元素被氧化,化合价升高3价,NH4
2,﹣3价的N元素被氧化,化合价升高3价,NH4 O3→
O3→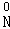 2,+5价的N元素化合价降低,被还原,化合价降低5价,
2,+5价的N元素化合价降低,被还原,化合价降低5价,
根据氧化还原反应中氧化剂和还原剂之间得失电子数目相等可知,被氧化的N原子与被还原的N原子个数之比是5:3,
故选B.
点评:
本题考查氧化还原反应的计算,题目难度不大,本题注意根据方程式判断元素的化合价的变化,判断N元素化合价的变化为解答该题的关键.


科目:高中化学 来源: 题型:
已知:2Na[Al(OH)4]+CO2→2Al(OH)3↓+Na2CO3+H2O.向含2mol NaOH,1mol Ba(OH)2,2mol Na[Al(OH)4]的混合溶液中慢慢通入CO2,则通入CO2的量和生成沉淀的量关系正确的是( )
选项 A B C D
n(CO2)(mol) 2 3 4 6
n(沉淀)(mol) 1 2 3 3
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
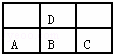
如图是元素周期表短周期的一部分,若A原子最外层的电子数比次外层的电子数少3,则下列说法中正确的是( )
|
| A. | D与C不能形成化合物 |
|
| B. | D的最高正价与B的最高正价相等 |
|
| C. | A、B、C的最高价氧化物对应的水化物酸性强弱的关系是C>B>A |
|
| D. | A、B、C、D原子所具有的原子轨道类型和数目都相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组中两种物质在溶液中的反应可用同一离子方程式表示的是( )
|
| A. | Cu(OH)2+HCl;Cu(OH)2+CH3COOH | B. | NaHCO3+H2SO4;Na2CO3+HCl |
|
| C. | NaHCO3+NaOH;Ca(HCO3)2+NaOH | D. | BaCl2+H2SO4;Ba(OH)2+Na2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列溶液中,跟100mL 0.5mol/L NaCl溶液所含的Cl﹣物质的量浓度相同的是( )
|
| A. | 100mL 0.5mol/L MgCl2溶液 |
|
| B. | 200mL 0.25mol/L CaCl2溶液 |
|
| C. | 50ml 1mol/L NaCl溶液 |
|
| D. | 25ml 2mol/L HCl溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
如图是硫酸试剂瓶标签上的内容:
(1).则该硫酸的物质的量浓度为 mol•L﹣1.
(2).某化学兴趣小组进行硫酸性质的实验探究时,需要240mL 4.6mol•L﹣1的稀H2SO4,现取上述浓硫酸稀释配制稀硫酸,则所需实验仪器有 ,所需量取 mL的该硫酸.
(3)下面是某学生的操作过程:
a.将浓硫酸倒入另一个盛有适量蒸馏水的烧杯中稀释,并冷却到室温;
b.用量筒量取浓硫酸;
c.用玻璃棒引流,将稀释后的硫酸倒入已检查不漏水的容量瓶中;
d.将所得溶液倒入试剂瓶,在试剂瓶上贴上标签待用.
e.用胶头滴管加水至凹液面底部与刻度线相切,摇匀;
f.轻轻摇动容量瓶,使瓶内液体混合均匀,再向容量瓶中加水至离刻度线1cm~2cm
g.洗涤烧杯和玻璃棒,并将洗涤液注入容量瓶.
正确的操作顺序是 .(用字母表示)
(4)在配制4.6mol•L﹣1的稀H2SO4的过程中,下列情况对硫酸溶液物质的量浓度有何影响(填“偏高”“偏低”或“无影响”)
①未经冷却趁热将溶液注入容量瓶中: ;
②容量瓶用1mol•L﹣1的稀H2SO4润洗: ;
③定容时仰视液面读数: .
④容量瓶有蒸馏水 .

查看答案和解析>>
科目:高中化学 来源: 题型:
新鲜水果、蔬菜、乳制品中富含的维生素C具有明显的抗衰老作用,但易被空气氧化.某课外小组利用碘滴定法测某橙汁中维生素C的含量,其化学方程式如下:
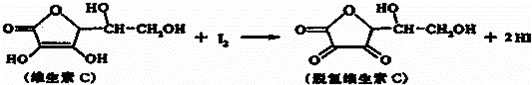
下列说法正确的是( )
|
| A. | 维生素C的分子式为C6H8O6 |
|
| B. | 维生素C在酸性条件下水解得到3种产物 |
|
| C. | 维生素C不溶于水,可溶于有机溶剂 |
|
| D. | 上述反应为取代反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
金属镍及其化合物在合金材料以及催化剂等方面应用广泛。根据要求回答下列问题:
(1)基态Ni的价电子构型(电子排布式)为______________________。
(2)Ni(CO)4常温为液态,易溶于CCl4、苯等有机溶剂,则Ni(CO)4属于_______晶体。
(3)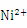 可与丁二酮肟(
可与丁二酮肟(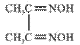 )作用生成腥红色配合物沉淀A。
)作用生成腥红色配合物沉淀A。
①丁二酮肟分子中碳原子的杂化轨道类型有______________,1mol该分子中含有的碳碳σ键和碳氮σ键的总数为__________。
②氨气在水中的溶解度远大于甲烷,其原因是____________。
③腥红色配合物沉淀A中(结构如下)除含有一般共价键外,还含有配位键和氢键,请在下图中标出配位键和氢键。
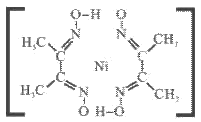
(提示: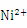 的配位数为4,配位键用“→”表示,氢键用“…”表示)
的配位数为4,配位键用“→”表示,氢键用“…”表示)
(4)据报道,某种含有镁、镍和碳三种元素的晶体具有超导性,该新型超导晶体的一个晶胞的结构如下图所示,则该晶体的化学式为__________。
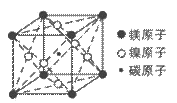
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com