
| 元素编号 | 元素性质或原子结构 |
| W | 原子电子层数与核外电子数相等 |
| X | 原子核外L层上s能级的电子总数为p能级上的电子总数的一半 |
| Y | 元素的原子半径在短周期中最大(除稀有气体外) |
| Z | 原子核外p能级上的电子总数等于s能级上的电子总数 |
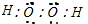 ,晶体镁属于金属晶体,
,晶体镁属于金属晶体,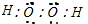 ;金属;
;金属;
| ||
| ||


科目:高中化学 来源: 题型:
| ||
| A、17.8 | B、16 |
| C、18.4 | D、35.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、硝酸银溶液中加入铜粉 Ag++Cu═Cu2++Ag↓ |
| B、氯化铁溶液中加入过量氨水 Fe3++3OH-=Fe(OH)3↓ |
| C、铝粉投入到NaOH溶液中 2Al+2OH-═2AlO2-+H2↑ |
| D、硫酸铜溶液中滴加氢氧化钡溶液 Ba2++2OH-+Cu2++SO42-═BaSO4↓+Cu(OH)2↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:
 试回答:
试回答:查看答案和解析>>
科目:高中化学 来源: 题型:

 的分子式
的分子式查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
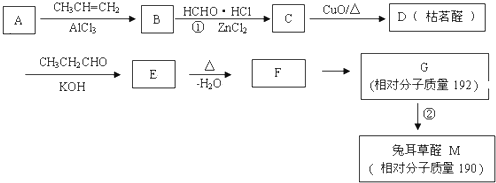

| KOH |
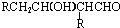
| △ |
| -H2O |

查看答案和解析>>
科目:高中化学 来源: 题型:
 ,B是同周期第一电离能最小的元素,C的最外层有三个未成对电子,E的外围电子排布式为3d64s2.回答下列问题:
,B是同周期第一电离能最小的元素,C的最外层有三个未成对电子,E的外围电子排布式为3d64s2.回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com