
| A. | ①③④⑤⑥ | B. | ②④⑤⑥ | C. | ⑤⑥ | D. | ④⑤ |
分析 溶液的酸碱性取决于溶液中c(OH+)、c(H+)的相对大小,如果c(OH+)<c(H+),则溶液呈酸性,如果c(OH+)=c(H+)则溶液呈中性,溶液c(OH+)>c(H+),则溶液呈碱性.
解答 解:①温度不知,pH<7的溶液不一定显酸性,如100°CPH=6的溶液为中性,故①错误;
②c(H+)=c(OH-)的溶液一定显中性,故②错误;
③c(H+)=l×10-6mol/L的溶液可能呈中性,100°C,PH=6的溶液为中性 c(H+)=l×10-6mol/L,故③错误;
④c(H+)>c(OH-)的溶液一定显酸性,故④正确;
⑤25℃下,PH=7为中性,当pH=6的溶液 一定显酸性,故⑤正确;
⑥常温下酚酞的变色范围为8-10,能使酚酞试液显无色的溶液可能为碱性,故⑥错误.
故选D.
点评 本题考查了水的电离、溶液酸碱性的判断,明确溶液的酸碱性取决于溶液中c(OH+)、c(H+)的相对大小是解本题的关键,题目难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | pH=3的盐酸和pH=11的氨水 | |
| B. | pH=3的盐酸和pH=11的氢氧化钡溶液 | |
| C. | pH=3的硫酸和pH=11的氨水 | |
| D. | pH=3的醋酸和pH=11的氢氧化钡溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | KClO3在反应中是还原剂 | |
| B. | 1molKClO3参加反应,在标准状况下能得到22.4L气体 | |
| C. | 反应中H2C2O4既不是氧化剂也不是还原剂 | |
| D. | 1molKClO3参加反应有1mol电子转移 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H+、SO42-、NO3-、Ba2+ | B. | K+、Cl-、CO32-、Na+ | ||
| C. | Cu2+、NO3-、OH-、Na+ | D. | K+、SO42-、HCO3-、H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 摩尔表示物质的质量的单位 | B. | 16gO2含有0.5mol O2分子 | ||
| C. | 2gH2的体积约为22.4L | D. | 物质的摩尔质量等于其式量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| t/s | 0 | 50 | 150 | 250 | 350 |
| n(PCl3)/mol | 0 | 0.16 | 0.19 | 0.20 | 0.20 |
| A. | 反应在前50s 的平均速率 (PCl3)=0.0032mol•L-1•s-1 | |
| B. | 保持其他条件不变,升高温度,平衡时 (PCl3)=0.11mol•L-1,则反应的△H<0 | |
| C. | 相同温度下,起始时向容器中充入1.0mol PCl5、0.20mol PCl3和0.20mol Cl2,反应达到平衡前 (正)>(逆) | |
| D. | 相同温度下,起始时向容器中充入2.0mol PCl3和2.0mol Cl2,达到平衡时,PCl3的转化率小于80% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 石英玻璃、分子筛的主要成分是硅酸盐 | |
| B. | 分散系可分为溶液、浊液和胶体,浊液的分散质粒子大小介于溶液和胶体之间 | |
| C. | 铁在氧气中燃烧生成氧化铁,镁在空气中燃烧生成氧化镁、氮化镁 | |
| D. | 针对埃博拉病毒扩散情况,可选用含氯消毒剂对疫区可能的污染区域进行消毒预防 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
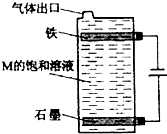 甲、乙、丙、丁、戊为原子序数依次增大的短周期元素.甲、丙处于同一主族,丙、丁、戊处于同一周期,戊的负一价阴离子与丙的阳离子差8个电子.甲、乙组成的常见气体X能使湿润的红色石蕊试纸变蓝;戊的单质与X反应能生成乙的单质,
甲、乙、丙、丁、戊为原子序数依次增大的短周期元素.甲、丙处于同一主族,丙、丁、戊处于同一周期,戊的负一价阴离子与丙的阳离子差8个电子.甲、乙组成的常见气体X能使湿润的红色石蕊试纸变蓝;戊的单质与X反应能生成乙的单质,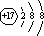 .
.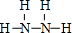 ;该物质与空气在碱性条件下可构成燃料电池,该电池放电时,负极的反应式为N2H4+4OH--4e-=N2↑+2H2O.
;该物质与空气在碱性条件下可构成燃料电池,该电池放电时,负极的反应式为N2H4+4OH--4e-=N2↑+2H2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 称量NaOH固体时,放在烧杯中且称量较慢 | |
| B. | 定容时,俯视刻度线 | |
| C. | 定容时,加水超过刻度线,再用胶头滴及将过线的液体吸出 | |
| D. | 移液前,容量瓶中有少量蒸馏水 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com