
| A. | 用广泛pH试纸测得某溶液的pH=6.7 | |
| B. | 滴定管洗净后经蒸馏水润洗,即可注入标准液进行滴定 | |
| C. | 可以选用氯水、四氯化碳来检验Cl-、Br-、I- | |
| D. | 在洁净的试管中加入1mL AgNO3溶液,再加入过量浓氨水,振荡制成银氨溶液 |
分析 A.pH试纸测定溶液的pH为整数;
B.滴定管洗净后经蒸馏水润洗,再用标准液润洗;
C.氯气和氯离子不反应,氯气和溴离子反应生成溴单质,溶液呈橙色;氯气和碘离子反应生成碘单质,碘溶液呈紫色;
D.银氨溶液配制方法为:在洁净的试管中加入2% AgNO3溶液1~2mL,逐滴加入2%稀NH3水,Ag++NH3•H2O═AgOH↓+NH4+,边滴边振荡,至沉淀恰好溶解时为止.
解答 解:A.pH试纸测定溶液的pH为整数而没有小数,故A错误;
B.滴定管洗净后经蒸馏水润洗,再用标准液润洗,否则会导致量取的溶液浓度偏低,故B错误;
C.氯气和氯离子不反应,氯气和溴离子反应生成溴单质,溶液呈橙色;氯气和碘离子反应生成碘单质,碘溶液呈紫色,反应现象不同,可以鉴别,故C正确;
D.银氨溶液配制方法为:在洁净的试管中加入2% AgNO3溶液1~2mL,逐滴加入2%稀NH3水,Ag++NH3•H2O═AgOH↓+NH4+,边滴边振荡,至沉淀恰好溶解时为止,故D错误;
故选C.
点评 本题考查化学实验方案评价,为高频考点,涉及仪器的洗涤和使用、pH的测定、离子检验、溶液配制等知识点,侧重考查基本操作、实验原理等知识点,明确仪器的使用方法、操作规范性即可解答,题目难度不大.


科目:高中化学 来源: 题型:选择题
 分析下列有机物的结构,判断该有机物可能发生的反应类型:( )
分析下列有机物的结构,判断该有机物可能发生的反应类型:( )| A. | 除④外其余都有 | B. | 全部 | C. | 只④⑤⑥⑦ | D. | 只①③⑤⑥⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:O<S<Na | B. | 稳定性:HF>H2S>HCl | ||
| C. | 酸性:H2SiO3<H2CO3<HNO3 | D. | 碱性:Al(OH)3<Mg(OH)2<NaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

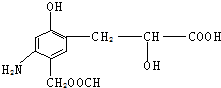
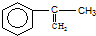 出发合成A,其合成路线如下:已知:A在酸性条件下水解生成有机物B和甲醇.
出发合成A,其合成路线如下:已知:A在酸性条件下水解生成有机物B和甲醇.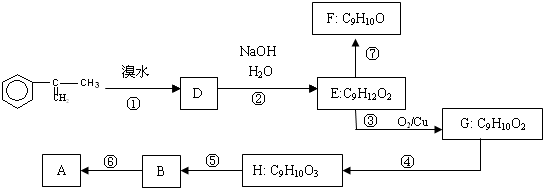
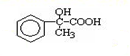 .
.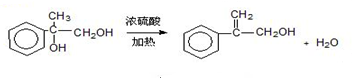 .
.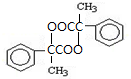 .
.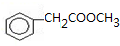 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
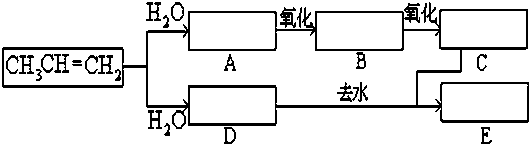
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 电离能(kJ/mol) | I1 | I2 | I3 | I4 |
| A | 932 | 1821 | 15390 | 21771 |
| B | 738 | 1451 | 7733 | 10540 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com