
【题目】下列反应的离子方程式书写正确的是( )
A.实验室用浓盐酸与MnO2反应制Cl2:MnO2+2H++2Cl-![]() Cl2↑+Mn2++H2O
Cl2↑+Mn2++H2O
B.向氯化铝溶液中加入过量的氨水:Al3++4NH3·H2O=AlO2-+4NH4++2H2O
C.醋酸洗涤铜器表面的碱式碳酸铜:Cu2(OH)2CO3+4H+=2Cu2++CO2↑+3H2O
D.向沸腾的蒸馏水中滴加饱和FeCl3溶液制备Fe(OH)3胶体:Fe3++3H2O![]() Fe(OH)3(胶体)+3H+
Fe(OH)3(胶体)+3H+
【答案】D
【解析】
A. 实验室用浓盐酸与MnO2反应制Cl2:MnO2+4H++2Cl-![]() Cl2↑+Mn2++H2O,故A错误;
Cl2↑+Mn2++H2O,故A错误;
B. 向氯化铝溶液中加入过量的氨水生成氢氧化铝,氢氧化铝具有两性,但只与强碱反应:Al3++3NH3·H2O=Al (OH)3↓+3NH4+,故B错误;
C. 醋酸洗涤铜器表面的碱式碳酸铜,醋酸为弱电解质,在离子反应中不能拆写:Cu2(OH)2CO3+4CH3COOH=2Cu2++4CH3COO-+CO2↑+3H2O,故C错误;
D. 向沸腾的蒸馏水中滴加饱和FeCl3溶液制备Fe(OH)3胶体,离子反应方程式为Fe3++3H2O![]() Fe(OH)3(胶体)+3H+,故D正确;
Fe(OH)3(胶体)+3H+,故D正确;
答案选D。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】K2Cr2O7溶液中存在平衡:Cr2O72-(橙色)+H2O![]() 2CrO42-(黄色)+2H+。用K2Cr2O7溶液进行下列实验:( )
2CrO42-(黄色)+2H+。用K2Cr2O7溶液进行下列实验:( )
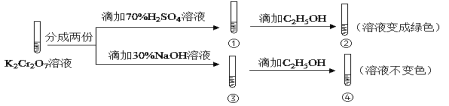
结合实验,下列说法不正确的是( )
A.若向④中加入70%H2SO4溶液至过量,溶液变为橙色
B.①中溶液橙色加深,③中溶液变黄
C.对比②和④可知K2Cr2O7酸性溶液氧化性强
D.②中Cr2O72-被C2H5OH还原
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列描述的化学反应状态,不一定是平衡状态的是( )
A.3H2(g)+N2(g)![]() 2NH3(g)反应体系中H2与N2的物质的量之比保持3∶1
2NH3(g)反应体系中H2与N2的物质的量之比保持3∶1
B.2NO2(g) ![]() N2O4(g)恒温、恒容下,反应体系中气体的压强保持不变
N2O4(g)恒温、恒容下,反应体系中气体的压强保持不变
C.CaCO3(s) ![]() O2(g)+CaO(s)恒温、恒容下,反应体系中气体的密度保持不变
O2(g)+CaO(s)恒温、恒容下,反应体系中气体的密度保持不变
D.H2(g)+Br2(g) ![]() 2HBr(g)恒温、恒容下,反应体系中气体的颜色保持不变
2HBr(g)恒温、恒容下,反应体系中气体的颜色保持不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把0.6mol X气体和0.4mol Y气体混合于2L容器中,发生反应:3X(g)+Y(g)== nZ(g)+2W(g),5min末已生成0.2mol W,若测知以Z浓度变化来表示的平均速率为0.03mol·L﹣1·min﹣1,计算:
(1)n的值为____;
(2)前5min内用X表示的反应速率_____;
(3)5min末Y的浓度_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】混合物A含有KAl(SO4)2、Al2O3和Fe2O3,在一定条件下发生如图所示的物质之间的变化:
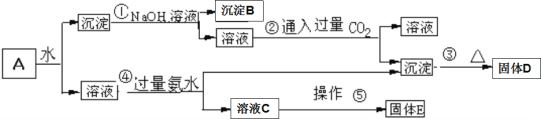
(1)固体D的化学式为___________
(2)写出反应①、④的离子方程式________________、_____________
(3)溶液C中含有的主要离子是______________________
(4)操作⑤是__________、______________________
(5)如图表示AlCl3与NaOH溶液相互滴加的两组实验过程中,微粒数量的关系曲线。判断下列说法不正确的是_____________
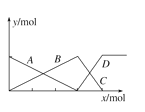
A.A线可表示Al3+或OH—的物质的量的变化
B.B C D线均可表示AlO2—的物质的量的变化
C.B C D线均可表示Al(OH)3的物质的量的变化
D.同一组实验中A、B、C、D线不可能全部出现
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有某硫酸和硝酸的混合溶液20 mL,其中含硫酸的浓度为2 mol·L-1,含硝酸的浓度为1 mol·L-1,现向其中加入0.96 g铜粉,充分反应后(假设只生成NO气体),最多可收集到标准状况下的气体的体积为( )
A.224 mLB.168 mL
C.112 mLD.89.6 mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 的a、b两种酸溶液各1mL,分别加水稀释到1000mL,其中pH与溶液体积V的关系如图所示。下列说法正确的是
的a、b两种酸溶液各1mL,分别加水稀释到1000mL,其中pH与溶液体积V的关系如图所示。下列说法正确的是![]()
![]()
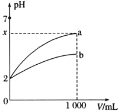
A.a、b两酸溶液的物质的量浓度一定相等
B.稀释后,a酸溶液的酸性比b酸溶液强
C.![]() 时,a是强酸,b是弱酸
时,a是强酸,b是弱酸
D.若a、b都是弱酸,则![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外活动小组欲利用 CuO 与 NH3 反应,研究 NH3 的某种性质并测定其组成, 设计了如下实验装置(夹持装置未画出)进行实验。请回答下列问题:
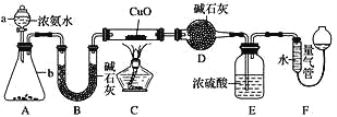
(1)仪器 a 的名称为 _____________。
(2)实验中观察到装置 C 中黑色 CuO 粉末变为红色固体,量气管有无色无味的气体,上述现象证明 NH3 具有 _____________性,写出相应的化学方程式 ____________。
(3)E 装置中浓硫酸的作用 ____________。
(4)读取气体体积前,应对装置 F 进行的操作:_____________。
(5)实验完毕,若测得干燥管 D 增重 mg,装置 F 测得气体的体积为 n L(已折算成标准状况),则氨分子中氮、氢的原子个数比为____________(用含 m、n 字母的代数式表示)
(6)在实验室中用图中 A 装置也可制取 SO2 气体:
①选用的药品可以是 _____________。
A.Na2SO3 溶液与 HNO3 B.Na2SO3 固体与浓 H2SO4
C.碳与浓 H2SO4 D.铜与浓 H2SO4
②将制得的 SO2通入淀粉碘化钾溶液,现象为 _________,表明 SO2 的氧化性比 I2___________(填“强或“弱”)。
③实验室用 NaOH 溶液作为 SO2 的吸收剂防止污染空气,若向 100mL 0.3mol/L 的 NaOH溶液中通入标准状况下 0.448LSO2 气体,所得溶液中的溶质是_________(填化学式)。
④某硫酸厂拟用含 Cr2O72-的酸性废水处理烟气中 SO2,反应后的铬元素以 Cr3+形式存在, 则反应中氧化剂和还原剂的物质的量之比是 ______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阅读下面的信息,推断元素及有关物质,按要求回答物质:
信息①:X、Y、Z、W是常见的短周期元素,其原子序数依次增大,且原子核外最外层电子数均不少于2。
(1)根据信息①:X一定不是_________(填序号).
A.氢 | B.碳 | C.氧 | D.硫 |
信息②:上述四种元素的单质均能在足量的氧气中燃烧,生成的四种氧化物中,有两种能溶
于稀硫酸,三种能溶于浓氢氧化钠溶液,氧化物的相对分子质量都大于26。
(2)这四种元素中是否可能有一种是铝元素?_____________________________________。
信息③:向上述四种元素单质组成的混合物中加入足量盐酸溶液,固体部分溶解,过滤,向
滤液中加入过量的烧碱溶液,最终溶液中析出白色沉淀。
(3)白色沉淀物的化学式为____________________________________________________。
信息④:向上述四种元素单质组成的混合物中加入足量烧碱溶液,固体部分溶解,过滤,向
滤液中加入过量的盐酸溶液,最终溶液中析出白色沉淀。
(4)生成白色沉淀物的离子方程式为____________________________________________。
信息⑤:X与W同主族
(5)X与浓硫酸加热时反应的化学方程式为_______________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com