
![]() 超细氧化铝是一种重要的功能陶瓷原料。
超细氧化铝是一种重要的功能陶瓷原料。
![]() (1)实验室常以NH4Al(SO4)2和NH4HCO3为原料,在一定条件下先反应生成沉淀NH4AlO(OH)HCO3该沉淀高温分解即得超细Al2O3。NH4AlO(OH)HCO3热分解的化学反应方程式 。
(1)实验室常以NH4Al(SO4)2和NH4HCO3为原料,在一定条件下先反应生成沉淀NH4AlO(OH)HCO3该沉淀高温分解即得超细Al2O3。NH4AlO(OH)HCO3热分解的化学反应方程式 。
![]() (2)NH4Al(SO4)2?12H2O的相对分子质量为453。欲配制100mLPH为2、浓度约为0.1mol-1的NH4Al(SO4)2溶液,配制过程为
(2)NH4Al(SO4)2?12H2O的相对分子质量为453。欲配制100mLPH为2、浓度约为0.1mol-1的NH4Al(SO4)2溶液,配制过程为
![]() ①用托盘天平称量NH4Al(SO4)2?12H2O固体 g;
①用托盘天平称量NH4Al(SO4)2?12H2O固体 g;
![]() ②将上述固体置于烧杯中 。
②将上述固体置于烧杯中 。
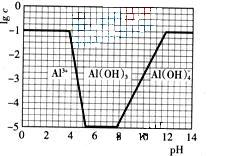
![]() (3)在0.1mol?L-1NH4Al(SO4)2溶液中,铝各形态的浓度(以Al3+计)的对数(lgc)随溶液PH变化的关系见下图
(3)在0.1mol?L-1NH4Al(SO4)2溶液中,铝各形态的浓度(以Al3+计)的对数(lgc)随溶液PH变化的关系见下图
![]()
![]() ①用NaOH溶液调节(2)中溶液PH至7,该过程中发生反应的离子方程式有 。
①用NaOH溶液调节(2)中溶液PH至7,该过程中发生反应的离子方程式有 。
![]() ②请在答题卡的框图中,画出0.01mol?L-1NH4Al(SO4)2溶液中铝各形态的浓度的对数lgc随溶液PH变化的关系图,并进行必要的标注。
②请在答题卡的框图中,画出0.01mol?L-1NH4Al(SO4)2溶液中铝各形态的浓度的对数lgc随溶液PH变化的关系图,并进行必要的标注。
![]()
![]() 【答案】【命题意图】考查考生对化学实验基本技能的了解、对常见离子反应方程式的掌握;考查考生从图形中获取信息并与与已有知识整合形成新知识的能力,以及用图形表达分析解决问题的过程和成果的能力。
【答案】【命题意图】考查考生对化学实验基本技能的了解、对常见离子反应方程式的掌握;考查考生从图形中获取信息并与与已有知识整合形成新知识的能力,以及用图形表达分析解决问题的过程和成果的能力。
(1)2NH4AlO(OH)HCO3![]() Al2O3+3H2O↑+2CO2↑+2NH3↑
Al2O3+3H2O↑+2CO2↑+2NH3↑
![]() (2)①4.5g;②用量筒量取100mL水,搅拌溶解,用H2SO4调节溶液PH至2
(2)①4.5g;②用量筒量取100mL水,搅拌溶解,用H2SO4调节溶液PH至2
![]() (3)① H++OH-=H2O NH4++ OH―= NH3?H2O Al3++3OH―=Al(OH)3↓;
(3)① H++OH-=H2O NH4++ OH―= NH3?H2O Al3++3OH―=Al(OH)3↓;
![]() ②
②
![]() 【解析】(1)根据NH4AlO(OH)HCO3组成联系到碳酸氢铵盐的分解可知:2NH4AlO(OH)HCO3
【解析】(1)根据NH4AlO(OH)HCO3组成联系到碳酸氢铵盐的分解可知:2NH4AlO(OH)HCO3![]() Al2O3+3H2O+2CO2↑+2NH3↑;
Al2O3+3H2O+2CO2↑+2NH3↑;
![]() (2)由物质的量浓度的定义公式可计算:
(2)由物质的量浓度的定义公式可计算:
![]() m(NH4Al(SO4)2?12H2O)=n?M(NH4Al(SO4)2?12H2O)=c?V?M(NH4Al(SO4)2?12H2O)
m(NH4Al(SO4)2?12H2O)=n?M(NH4Al(SO4)2?12H2O)=c?V?M(NH4Al(SO4)2?12H2O)
![]() =0.1mol/L×100mL×10-3×453g/mol=4.53g,由于托盘天平的精确度为0.1g,故为4.5g;
=0.1mol/L×100mL×10-3×453g/mol=4.53g,由于托盘天平的精确度为0.1g,故为4.5g;
![]() (3)①由图像可知,开始阶段c(Al3+)没变化;而后c(Al3+)降低,生成Al(OH)3沉淀;当pH>8,Al(OH)3沉淀开始溶解。调节pH至7,OH―先跟NH4+反应,然后与Al3+反应生成Al(OH)3沉淀。
(3)①由图像可知,开始阶段c(Al3+)没变化;而后c(Al3+)降低,生成Al(OH)3沉淀;当pH>8,Al(OH)3沉淀开始溶解。调节pH至7,OH―先跟NH4+反应,然后与Al3+反应生成Al(OH)3沉淀。
![]() 【考点分析】考查对化学实验基本技能的了解,对常见离子方程式的掌握。
【考点分析】考查对化学实验基本技能的了解,对常见离子方程式的掌握。
![]()
![]()


科目:高中化学 来源: 题型:
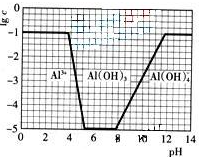 (2009?广东)超细氧化铝是一种重要的功能陶瓷原料.
(2009?广东)超细氧化铝是一种重要的功能陶瓷原料. Al2O3+3H2O↑+2CO2↑+2NH3↑
Al2O3+3H2O↑+2CO2↑+2NH3↑ Al2O3+3H2O↑+2CO2↑+2NH3↑
Al2O3+3H2O↑+2CO2↑+2NH3↑查看答案和解析>>
科目:高中化学 来源: 题型:
(1)实验室常以NH4Al(SO4)2和NH4HCO3为原料,在一定条件下先反应生成沉淀NH4AlO(OH)HCO3,该沉淀高温分解即得超细Al2O3。NH4AlO(OH)HCO3热分解的化学反应方程式为_________________________。
(2)NH4Al(SO4)2·12H2O的相对分子质量为453。欲配制100 mL pH为2、浓度约为0.1 mol·L-1的NH4Al(SO4)2溶液,配制过程为:
①用托盘天平称量NH4Al(SO4)2·12H2O固体______________________g;
②将上述固体置于烧杯中,_________________________。
(3)在0.1 mol·L-1 NH4Al(SO4)2溶液中,铝各形态的浓度(以Al3+计)的对数(lgc)随溶液pH变化的关系见下图:

①用NaOH溶液调节(2)中溶液pH至7,该过程中发生反应的离子方程式有___________。
②请在答题卡的框图中,画出0.01 mol·L-1 NH4Al(SO4)2溶液中铝各形态的浓度的对数lgc随溶液pH变化的关系图,并进行必要标注。
查看答案和解析>>
科目:高中化学 来源: 题型:
(11分)
超细氧化铝是一种重要的功能陶瓷原料。
(1)实验室常以NH4Al(SO4)2和NH4HCO3为原料,在一定条件下先反应生成沉淀NH4AlO(OH)HCO3该沉淀高温分解即得超细Al2O3。NH4AlO(OH)HCO3热分解的化学反应方程式 。
(2)NH4Al(SO4)2·12H2O的相对分子质量为453。欲配制100mLPH为2、浓度约为0.1mol-1的NH4Al(SO4)2溶液,配制过程为
①用托盘天平称量NH4Al(SO4)2·12H2O固体 g;
②将上述固体置于烧杯中 。
(3)在0.1mol·L-1NH4Al(SO4)2溶液中,铝各形态的浓度(以Al3+计)的对数(lgc)随溶液PH变化的关系见下图
①用NaOH溶液调节(2)中溶液PH至7,该过程中发生反应的离子方程式有 。
②请在答题卡的框图中,画出0.01mol·L-1NH4Al(SO4)2溶液中铝各形态的浓度的对数lgc随溶液PH变化的关系图,并进行必要的标注。
查看答案和解析>>
科目:高中化学 来源:2009年普通高等学校招生统一考试化学试题(广东卷) 题型:填空题
(11分)
超细氧化铝是一种重要的功能陶瓷原料。
 (1)实验室常以NH4Al(SO4)2和NH4HCO3为原料,在一定条件下先反应生成沉淀NH4AlO(OH)HCO3该沉淀高温分解即得超细Al2O3。NH4AlO(OH)HCO3热分解的化学反应方程式
。
(1)实验室常以NH4Al(SO4)2和NH4HCO3为原料,在一定条件下先反应生成沉淀NH4AlO(OH)HCO3该沉淀高温分解即得超细Al2O3。NH4AlO(OH)HCO3热分解的化学反应方程式
。
(2)NH4Al(SO4)2·12H2O的相对分子质量为453。欲配制100mLPH为2、浓度约为0.1mol-1的NH4Al(SO4)2溶液,配制过程为
 ①用托盘天平称量NH4Al(SO4)2·12H2O固体
g;
①用托盘天平称量NH4Al(SO4)2·12H2O固体
g;
②将上述固体置于烧杯中 。
 (3)在0.1mol·L-1NH4Al(SO4)2溶液中,铝各形态的浓度(以Al3+计)的对数(lgc)随溶液PH变化的关系见下图
(3)在0.1mol·L-1NH4Al(SO4)2溶液中,铝各形态的浓度(以Al3+计)的对数(lgc)随溶液PH变化的关系见下图
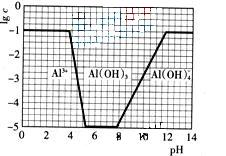
 ①用NaOH溶液调节(2)中溶液PH至7,该过程中发生反应的离子方程式有
。
①用NaOH溶液调节(2)中溶液PH至7,该过程中发生反应的离子方程式有
。
②请在答题卡的框图中,画出0.01mol·L-1NH4Al(SO4)2溶液中铝各形态的浓度的对数lgc随溶液PH变化的关系图,并进行必要的标注。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com