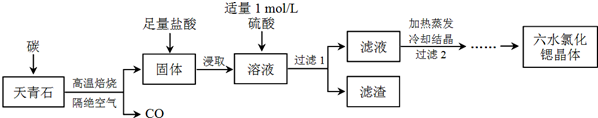
善于提出问题、探究问题和解决问题是学好化学的重要的方法.某同学在学习铁及其化合物知识时提出了下列问题:
问题1:铁为何称为黑色金属?
问题2:经查证,氧化性:Fe
2O
3>Fe
3O
4>FeO,用CO还原氧化铁得到的黑色固体一定是单质铁吗?有没有生成Fe
3O
4或FeO的可能?
问题3:Fe
3+和SO
32-之间可能发生的反应有:2Fe
3++SO
32-+H
2O═2Fe
2++SO
42-+2H
+(氧化还原反应),2Fe
3++3SO
32-+6H
2O═2Fe(OH)
3(胶体)+3H
2SO
3(水解反应).实际反应究竟是哪一个?
(1)对于问题1,同学们上网查寻,有两种解释:
A.因为在铁表面上有黑色的铁的氧化物,所以叫黑色金属.
B.因为铁的粉末为黑色,铁的氧化物也均为黑色,所以叫黑色金属.
①你认为正确的说法是
.
②有一黑色粉末,可能是铁粉、Fe
3O
4粉末、FeO粉末中的一种,请你设计一种实验方案进行检验
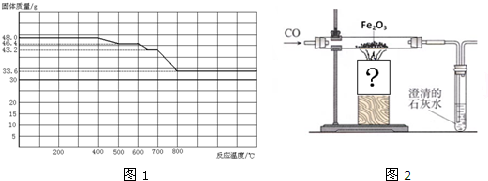
(2)对于问题2,同学们 参观了某钢铁厂,获得了用SDTQ热分析仪对CO与Fe
2O
3进行热反应的有关数据,绘制成固体质量与反应温度的关系曲线图(见图1)
①根据图象分析,反应温度500℃-600℃时残留固体的成分是
.
②写出固体质量由43.2 g变为33.6 g时的化学方程式
.
③已知:酒精灯火焰温度为600℃左右,酒精喷灯火焰温度高于800℃.钢铁厂有含铁、Fe
2O
3、Fe
3O
4、FeO的混合粉末,某同学为了帮助钢铁厂测定其含铁元素的质量分数,称取
m1g样品,设计了如图2所示的实验装置进行实验,当铁的氧化物全部还原为铁时,在CO的保护下冷却,称得残留固体的质量为
m2g.实验时应选择
灯加热,判断铁的氧化物全部还原为铁的方法是
.该装置还有没有缺陷?如果有,请提出改进意见
(如没有,该空不填).
(3)对于问题3,同学们进行了实验探究:取5 mL FeCl
3溶液于试管中,逐滴加入Na
2SO
3液至过量,观察到溶液颜色由黄色逐渐变为红褐色,无气泡产生,无沉淀生成,但有丁达尔现象.取红褐色液体少许,逐滴加入稀盐酸至过量,加入BaCl
2溶液,有少量白色沉淀生成.据此实验现象,你得出的结论是
.