甲醇具有开发和应用广阔的前景.工业上一般采用下列两种途径合成甲醇:
途径Ⅰ:CO
2(g)+3H
2(g)?CH
3OH(g)+H
2O(g)△H
1途径Ⅱ:CO(g)+2H
2(g)?CH
3OH(g)△H
2(1)上述反应符合“原子经济”规律的是
.
(2)下列各项中,能够说明反应Ⅱ已达到平衡的是
.
a.恒温、恒容条件下,容器内的压强不发生变化
b.一定条件下,CO、H
2和CH
3OH的浓度保持不变
c.一定条件下,CH
3OH分解的速率和CH
3OH生成的速率相等
d.一定条件下,单位时间内消耗1mol CO,同时生成1mol CH
3OH
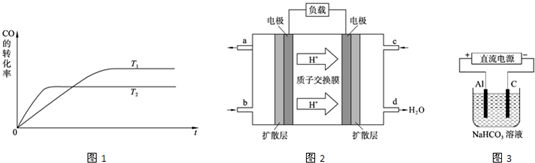
(3)如图是反应途径Ⅱ在不同温度下CO的转化率随时间变化的曲线.
①该反应的焓变△H
2_
_0(填“>”、“<”或“=”).
②如表所列数据是反应途径Ⅱ在不同温度下的化学平衡常数(K).
| 温度 |
250℃ |
350℃ |
| K |
2.041 |
0.012 |
请用化学平衡常数解释上面①中你的判断:
.
(4)已知在常温常压下:
①2CH
3OH(l)+3O
2(g)=2CO
2(g)+4H
2O(g)△H=-a kJ?mol
-1②2CO(g)+O
2(g)=2CO
2(g)△H=-b kJ?mol
-1③H
2O(g)=H
2O(l)△H=-c kJ?mol-1
则,CH
3OH(l)+O
2(g)=CO(g)+2H
2O(l)△H=
kJ?mol
-1.
(5)用甲醇作燃料,KOH溶液作电解液,惰性电极材料组成的原电池工作时,其正极反应式
;负极反应式
.

 甲醇具有开发和应用广阔的前景.工业上一般采用下列两种途径合成甲醇:
甲醇具有开发和应用广阔的前景.工业上一般采用下列两种途径合成甲醇:



 甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上一般可采用如下反应来合成甲醇:CO(g)+2H2(g)?CH3OH(g).
甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上一般可采用如下反应来合成甲醇:CO(g)+2H2(g)?CH3OH(g).