
| A. | 硫酸型酸雨的形成会涉及反应:2H2SO3+O2$\frac{\underline{\;催化剂\;}}{\;}$2H2SO4 | |
| B. | 工业上制取粗硅的化学方程式SiO2+C$\frac{\underline{\;高温\;}}{\;}$Si+CO2↑ | |
| C. | 成分为盐酸的洁厕灵与84消毒液混合使用易中毒:Cl?+ClO?+2H+=Cl2↑+H2O | |
| D. | Na2S2O3溶液中加入稀硫酸:S2O32-+2H+=SO2↑+S↓+H2O |
分析 A.正常雨水溶解二氧化碳,硫酸型酸雨中溶解二氧化硫,酸性增强;
B.工业上制取粗硅,二氧化硅和碳反应生成硅和一氧化碳;
C.成分为盐酸的洁厕灵与84消毒液(NaClO)混合,发生氧化还原反应生成氯气;
D.向Na2S2O3溶液中加入稀硫酸,反应生成硫单质和二氧化硫气体.
解答 解:A.正常雨水溶解二氧化碳,硫酸型酸雨中溶解二氧化硫,酸性增强,是因为二氧化硫被空气中的氧气氧化成硫酸,则硫酸型酸雨的形成会涉及反应为2H2SO3+O2$\frac{\underline{\;催化剂\;}}{\;}$2H2SO4,故A正确;
B.工业上制硅的反应方程式为:SiO2+2C $\frac{\underline{\;高温\;}}{\;}$Si+2CO↑,故B错误;
C.成分为盐酸的洁厕灵与84消毒液(NaClO)混合,发生氧化还原反应,离子反应为Cl-+ClO-+2H+═Cl2↑+H2O,故C正确;
D.硫代硫酸钠与稀硫酸反应生成硫单质和二氧化硫气体,反应的离子方程式为:S2O32-+2H+═SO2↑+S↓+H2O,故D正确;
故选B.
点评 本题考查物质的性质及离子反应,为高频考点,把握物质的性质及生活中的应用为解答的关键,侧重分析与迁移应用能力的考查,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
 +2KMnO4$\stackrel{△}{→}$
+2KMnO4$\stackrel{△}{→}$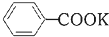 +KOH+2MnO2↓+H2O
+KOH+2MnO2↓+H2O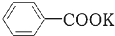 +HCl→
+HCl→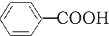 +KCl
+KCl| 名称 | 相对分 子质量 | 性状 | 熔点 | 沸点 | 密度 | 溶解度 | ||
| 水 | 乙醇 | 乙醚 | ||||||
| 甲苯 | 92 | 无色液体易燃易挥发 | -95 | 110.6 | 0.8669 | 不溶 | 易溶 | 易溶 |
| 苯甲酸 | 122 | 白色片状或针状晶体 | 122.4 | 248 | 1.2659 | 微溶 | 易溶 | 易溶 |
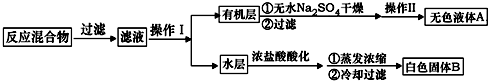
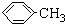 .操作Ⅱ为蒸馏.
.操作Ⅱ为蒸馏.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Mg变为MgO时化合价升高,因此,Mg在该反应中作还原剂 | |
| B. | KMnO4受热分解时,Mn元素化合价一方面升高一方面降低,因此,在该反应中Mn元 素既被氧化又被还原 | |
| C. | 凡是氧化还原反应都能造福人类 | |
| D. | 在反应2H2O$\frac{\underline{\;电解\;}}{\;}$2H2↑+O2↑中H2O是还原剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
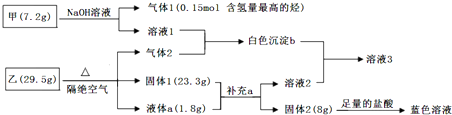
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
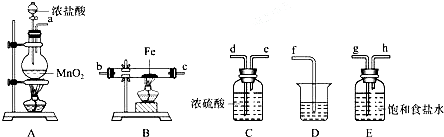
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一定条件下,该反应在任何温度下均能自发进行 | |
| B. | 反应CO(g)+Cl2(g)?COCl2(g)△H=+Q kJ•mol-1 化学平衡常数为K | |
| C. | 反应2COCl2(g)?2CO(g)+2Cl2(g) 化学平衡常数为2K | |
| D. | 将1mol COCl2 (g)置于一密闭容器中充分反应后放出QkJ的热量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 22.4L CO中一定含有6.02×1023个分子 | |
| B. | 在标准状况下,22.4L CH4与18g H2O所含有的电子数均为10 NA | |
| C. | 常温常压下,16g O2 与16gO3含有的分子数相同 | |
| D. | 0.1 mol/L K2SO4 溶液中含有 K+为0.2 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溴水中有下列平衡Br2+H2O?HBr+HBrO,当加入AgNO3溶液后,溶液颜色变浅 | |
| B. | 反应H2(g)+I2(g)?2HI(g) 达到平衡后,压缩容器的体积,体系颜色加深 | |
| C. | 反应CO(g)+NO2(g)═CO2(g)+NO(g)△H<0,达平衡后,升高温度体系颜色变深 | |
| D. | 增大压强,有利于SO2与O2反应生成SO3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com